ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ. Определение отношения теплоемкостей воздуха с по-мощью уравнений изопроцессов в идеальном газе.ЦЕЛЬ РАБОТЫ
Определение отношения теплоемкостей воздуха с по-мощью уравнений изопроцессов в идеальном газе.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Теплоемкостью тела называется величина, равная отно-шению бесконечно малого количества поглощенной теплоты
Если теплоемкость не зависит от температуры, то из оп-ределения следует, что она численно равна теплоте, погло-щаемой телом при нагревании на единицу температуры. Теплоемкость единицы массы вещества называется удель-ной теплоемкостью, теплоемкость одного моля вещества – молярной теплоемкостью. Далее будем рассматривать мо-лярные теплоемкости. Количество теплоты, поглощаемой телом, и, следова-тельно, теплоемкость тела зависят от способа нагревания. Различают теплоемкость при постоянном объеме По Первому началу термодинамики количество теплоты
где При изохорном нагревании газа (
При изобарном нагревании ( Давление: Объем: Температура: Запишем уравнение Менделеева–Клапейрона для состоя-ния 1:
где При переходе в состояние 2 газ при постоянном давле-нии увеличил свой объем на величину Давление: Объем: Температура: Уравнение Менделеева–Клапейрона для состояния 2:
Вычтем из (1.2.4) выражение (1.2.5)
и получим выражение для работы, совершенной газом:
Из (1.2.6) виден физический смысл универсальной газо-вой постоянной
Подставим полученное выражение для работы (1.2.6) в уравнение Первого начала термодинамики (1.2.2):
и отсюда, с учетом (1.2.1), получаем выражение для тепло-емкости при постоянном давлении:
Подставляя в (1.2.8) выражение для
называемое уравнением Майера. Из уравнения Майера вид-но, что теплоемкости при постоянном давлении и объеме отличаются на константу. Из этого следует, что и отно-шение теплоемкостей – тоже величина постоянная. Вместе с тем неясно, от чего зависит теплоемкость Внутренняя энергия газа зависит от числа степеней сво-боды молекул, составляющих газ. Числом степеней свобо-ды системы называется число независимых координат, оп-ределяющих положение системы в пространстве. Моле-кулы, состоящие из различного количества атомов, обла-дают и различным числом степеней свободы Из теоремы о равномерном распределении энергии по степеням свободы следует, что на каждую поступательную и вращательную степень свободы молекулы приходится одинаковая (в среднем) энергия, пропорциональная абсо-лютной температуре газа:
Соответственно, если молекула обладает
Тогда 1 моль идеального газа (газа, в котором можно пре-небречь взаимодействием молекул), состоящий из молекул с
Таким образом, для молярной теплоемкости при посто-янном объеме
Из уравнения Майера получаем выражение для теплоем-кости при постоянном давлении:
Тогда и отношение теплоемкостей есть величина посто-янная, зависящая от числа степеней свободы молекул газа:
Если экспериментально определить величину
Величина
Адиабатический процесс тоже относится к изопроцессам, т.к. в отсутствие теплообмена энтропия
остается неизменной ( Адиабатический процесс еще называется изоэнтропным, или Исходя из физического смысла показателя адиабаты ло-гично сделать вывод, что эксперимент по определению ве-личины
Состояние идеального газа при изотермическом процессе (
С учетом того, что
Уравнение (1.2.17) для адиабаты 1-2 записывается как:
Уравнения (1.2.20) и (1.2.21) образуют систему уравне-ний, решая которую, мы найдем величину
и поделим его на уравнение (1.2.21). Получим:
Логарифмируя уравнение (1.2.22), получим искомую величину:
где Выражение (1.2.23) можно упростить, если во время про-ведения цикла давление
Тогда из рис. 1.2.1 следует, что
Соответственно выражение (1.2.22) для определения γ приобретает вид:
Используя разложение функции логарифма в ряд Маклорена и сохраняя только первый член разложения
Для выяснения физического смысла полученного при-ближения (1.2.28) запишем уравнение изотермы (1.2.19) и адиабаты (1.2.17) в дифференциальном виде:
Из сравнения формул (1.2.29) и (1.2.30) очевидно, что отношение теплоемкостей
Объединяя соотношения (1.2.31) и (1.2.32), получаем ра-венство:
которое выполняется при любых заданных значениях
Таким образом, для отношения теплоемкостей вновь по-лучаем выражение (1.2.28):
которое в работе используется в качестве расчетного. Преимущество данного подхода и полученного прибли-женного соотношения (1.2.36) заключается в его простоте, высокой точности и возможности измерения давления в произвольных единицах (например в мм водяного столба). В настоящей работе
|

 к бесконечно малому повышению температуры
к бесконечно малому повышению температуры  , вызванному поглощением этой теплоты:
, вызванному поглощением этой теплоты: . (1.2.1)
. (1.2.1) и теп-лоемкость при постоянном давлении
и теп-лоемкость при постоянном давлении 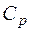 .
. , (1.2.2)
, (1.2.2) означает не приращение какой-либо функции а элементарное количество теплоты
означает не приращение какой-либо функции а элементарное количество теплоты 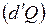 и работы
и работы  .
. ) не происходит изменение объема (
) не происходит изменение объема ( ), и поэтому работа газа
), и поэтому работа газа  тоже равна нулю. Теплота, поглощенная телом, идет только на увеличение внутренней энергии тела (
тоже равна нулю. Теплота, поглощенная телом, идет только на увеличение внутренней энергии тела ( ). Исходя из этого теплоемкость
). Исходя из этого теплоемкость  равна
равна . (1.2.3)
. (1.2.3) ) один моль расши-ряющегося газа совершает против внешних сил работу
) один моль расши-ряющегося газа совершает против внешних сил работу  ,
, ,
, .
.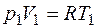 , (1.2.4)
, (1.2.4) – универсальная газовая постоянная.
– универсальная газовая постоянная.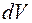 и температуру – на
и температуру – на  ,
, ,
, .
.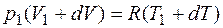 (1.2.5)
(1.2.5)
 . (1.2.6)
. (1.2.6) ), полу-чим работу, совершаемую одной молекулой против внеш-них сил при тех же условиях нагревания. Эта работа чис-ленно равна постоянной Больцмана
), полу-чим работу, совершаемую одной молекулой против внеш-них сил при тех же условиях нагревания. Эта работа чис-ленно равна постоянной Больцмана  :
: (1.2.7)
(1.2.7) ,
, . (1.2.8)
. (1.2.8) , получаем урав-нение
, получаем урав-нение , (1.2.9)
, (1.2.9) . Для одно-атомного газа
. Для одно-атомного газа 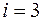 , для двухатомного
, для двухатомного  , для газа, моле-кулы которого состоят из трех и большего количества ато-мов,
, для газа, моле-кулы которого состоят из трех и большего количества ато-мов,  .
. . (1.2.10)
. (1.2.10) . (1.2.11)
. (1.2.11) . (1.2.12)
. (1.2.12) . (1.2.13)
. (1.2.13)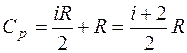 . (1.2.14)
. (1.2.14) . (1.2.15)
. (1.2.15) , то из (1.2.15) можно найти количество степеней свободы молекул данного газа:
, то из (1.2.15) можно найти количество степеней свободы молекул данного газа: . (1.2.16)
. (1.2.16) ). Состояние иде-ального газа при адиабатическом процессе описывается уравнением Пуассона:
). Состояние иде-ального газа при адиабатическом процессе описывается уравнением Пуассона: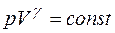 . (1.2.17)
. (1.2.17) системы, опре-деляемая как
системы, опре-деляемая как (1.2.18)
(1.2.18) ).
). . Но если система находится в тепловом равновесии со средой, имеющей тем-пературу
. Но если система находится в тепловом равновесии со средой, имеющей тем-пературу  , то из энергии системы
, то из энергии системы  . Величина
. Величина  на-зывается связанной энергией. Она передается только через теплообмен. Поскольку связанная энергия пропорциональна энтропии, то энтропия характеризует обесцененность энер-гии системы: энтропия возрастает во всех процессах, уменьшающих способность системы производить работу.
на-зывается связанной энергией. Она передается только через теплообмен. Поскольку связанная энергия пропорциональна энтропии, то энтропия характеризует обесцененность энер-гии системы: энтропия возрастает во всех процессах, уменьшающих способность системы производить работу.
 ) описывается уравнением Бойля-Мариотта
) описывается уравнением Бойля-Мариотта . (1.2.19)
. (1.2.19) , уравнение (1.2.19) для изо-термы 3-1 имеет вид:
, уравнение (1.2.19) для изо-термы 3-1 имеет вид: . (1.2.20)
. (1.2.20) . (1.2.21)
. (1.2.21) ,
, , или
, или  . (1.2.22)
. (1.2.22) , (1.2.23)
, (1.2.23) – давление газа, соответственно, в состоя-ниях 1,2,3 цикла, указанного на рис.1.2.1.
– давление газа, соответственно, в состоя-ниях 1,2,3 цикла, указанного на рис.1.2.1. незначительно отличается от
незначительно отличается от  . Введем следующие обозначения для давления, пре-вышающего
. Введем следующие обозначения для давления, пре-вышающего  ; (1.2.24)
; (1.2.24) . (1.2.25)
. (1.2.25) . (1.2.26)
. (1.2.26) . (1.2.27)
. (1.2.27) из (1.2.27), окончательно получаем
из (1.2.27), окончательно получаем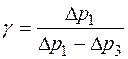 . (1.2.28)
. (1.2.28)
 ; (1.2.29)
; (1.2.29)
 . (1.2.30)
. (1.2.30) , (1.2.31)
, (1.2.31) . (1.2.32)
. (1.2.32) , (1.2.33)
, (1.2.33) и
и  . Если по-прежнему считать, что в ходе цикла изменения
. Если по-прежнему считать, что в ходе цикла изменения  соответственно рав-ны:
соответственно рав-ны: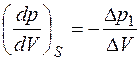 , (1.2.34)
, (1.2.34) (1.2.35)
(1.2.35) , (1.2.36)
, (1.2.36)


