Идеальный газ. Изопроцессы.
Состояние газа (так же как жидкости и твердого тела) может быть описано и без рассмотрения молекулярного строения вещества. Это делают с помощью макроскопических величин, совокупность которых однозначно определяет состояние системы. Такие величины называют параметрами состояния (или термодинамическими параметрами). Параметрами состояния любой системы являются ее объем, давление и температура. Если в каком-либо процессе изменяется хотя бы один из параметров состояния системы, то и само состояние системы становится другим. Идеальным называют газ, при описании свойств которого делают два допущения: не учитывают собственный размер газовых молекул и не учитывают силы взаимодействия между молекулами. Таким образом, моделью идеального газа является совокупность хаотически движущихся материальных точек, взаимодействующих между собой и со стенками содержащего газ сосуда только при непосредственном столкновении. Все газы при не слишком высоких давлениях и при не слишком низких температурах близки по своим свойствам к идеальному газу. При высоких давлениях молекулы газа настолько сближаются, что пренебрегать их собственными размерами нельзя. При понижении температуры кинетическая энергия молекул уменьшается и становится сравнимой с их потенциальной энергией, следовательно, при низких температурах пренебрегать потенциальной энергией нельзя. Таким образом, при высоких давлениях и низких температурах газ не может считаться идеальным. Изопроцессы идеального газа Процессы, в которых один из параметров состояния газа не изменяется называются изопроцессами. Закономерности изопроцессов, происходящих с идеальным газом, были установлены экспериментальным путем, их называют эмпирическими законами идеального газа. Изотермический процесс. Закон Бойля — Мариотта (m = const, Т = const)
График закона Бойля — Мариотта (изотерма) в координатах р, V имеет вид гиперболы. Так как плотность r = m/V, то
Изобарный процесс. Закон Гей-Люссака (m = const, р = const). Процесс, при котором давление газа постоянно, а температура и объем газа изменяются, называют изобарным. (Чтобы осуществить изобарный процесс, необходимо нагревать или охлаждать газ в цилиндре не закрепляя поршень.) Обозначим V0 объем газа при 0°С, а V - его объем при t°C. При нагревании на t°C объем газа увеличивается на DV = V – V0. Установлено, что относительное изменение объема газа при постоянном давлении пропорционально изменению его температуры, т. е. (V – V0)/ V0 = bt, где b - термический коэффициент объемного расширения газа (численно равен относительному изменению объема газа, происходящему при его нагревании на 1 °С). [b] = К-1 (так как 1°С = 1 К).
График (изобара) представляет собой прямую, наклоненную к оси абсцисс и пересекающую ось ординат в точке, соответствующей объему газа при 0°С. Изохорный процесс. Закон Шарля (m = const, V = const). Процесс, при котором объем газа постоянен, а температура и давление газа изменяются, называют изохорным. (Чтобы осуществить изохорный процесс, необходимо нагревать или охлаждать газ в закрытом сосуде). Обозначим р0 давление газа при 0°С, а р - его давление при t°C. При нагревании газа на t°C его давление увеличивается на Dр = р - ро. Установлено, что относительное изменение давления газа пи постоянном объеме пропорционально изменению температуры газа, т. е. (р – р0)/р0 = gt, где g - температурный коэффициент давления газа (равен относительному изменению давления газа, происходящему при его нагревании на 1 °С). [g] = К-1.
График закона Шарля (изохора) представляет собой прямую, наклоненную к оси абсцисс и пересекающую ось ординат в точке, соответствующей делению газа при 0°С.
|

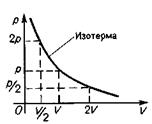 Процесс, при котором давление и объем газа меняются, а температура остается постоянной, называют изотермическим. (Чтобы осуществить изотермический процесс, необходимо сжимать или расширять газ очень медленно). Закон Бойля — Мариотта: при неизменной массе газа и постоянной температуре произведение объема газа на его давление есть величина постоянная.
Процесс, при котором давление и объем газа меняются, а температура остается постоянной, называют изотермическим. (Чтобы осуществить изотермический процесс, необходимо сжимать или расширять газ очень медленно). Закон Бойля — Мариотта: при неизменной массе газа и постоянной температуре произведение объема газа на его давление есть величина постоянная. 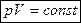
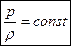 - при неизменной массе газа и постоянной температуре плотность газа пропорциональна его давлению.
- при неизменной массе газа и постоянной температуре плотность газа пропорциональна его давлению. Гей-Люссак установил, что для всех идеальных газов b = 1/273.
Гей-Люссак установил, что для всех идеальных газов b = 1/273.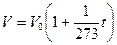 - закон Гей-Люссака, описывающий изобарный процесс: при неизменной массе газа и постоянном давлении термический коэффициент объемного расширения у всех газов одинаков и равен 1/273.
- закон Гей-Люссака, описывающий изобарный процесс: при неизменной массе газа и постоянном давлении термический коэффициент объемного расширения у всех газов одинаков и равен 1/273.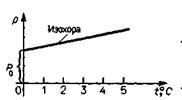 Шарль установил, что для всех идеальных газов g = 1/273.
Шарль установил, что для всех идеальных газов g = 1/273.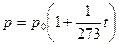 - закон Шарля, описывающий изохорный процесс: при неизменной массе газа и постоянном объеме температурный коэффициент давления у всех газов одинаков и равен 1/273.
- закон Шарля, описывающий изохорный процесс: при неизменной массе газа и постоянном объеме температурный коэффициент давления у всех газов одинаков и равен 1/273.


