Основные положения МКТ. Доказательство существования молекул. Размеры и масса молекул.
Основные положения молекулярно-кинетической теории. 1). Любое вещество имеет дискретное (прерывистое) строение. Оно состоит из мельчайших частиц — молекул и атомов, разделенных между собой промежутками. Молекулы являются наименьшими частицами, обладающими химическими свойствами данного вещества. Атомы являются наименьшими частицами, обладающими свойствами химических элементов, входящих в состав данного вещества. 2). Молекулы находятся в состоянии непрерывного хаотического движения, называемого тепловым. При нагревании вещества скорость теплового движения и кинетическая энергия его частиц увеличиваются, а при охлаждении — уменьшаются. Степень нагретости тела характеризуется его температурой, которая является мерой средней кинетической энергии поступательного движения молекул этого тела. 3). Между молекулами в процессе их взаимодействия возникают силы притяжения и отталкивания. Экспериментальное обоснование молекулярно-кинетической теории Наличие у веществ проницаемости, сжимаемости и растворимости свидетельствует о том, что они не сплошные, а состоят из отдельных, разделенных промежутками частиц. С помощью современных методов исследования (электронный и ионный микроскопы) удалось получить изображения наиболее крупных молекул. Наблюдения броуновского движения и диффузии частиц показали, что молекулы находятся в непрерывном движении. Наличие прочности и упругости тел, смачиваемости, прилипания, поверхностного натяжения в жидкостях и т. д. — все это доказывает существование сил взаимодействия между молекулами. Броуновское движение. В 1827 г. английский ботаник Броун, наблюдая в микроскоп взвесь цветочной пыльцы в воде, обнаружил, что крупинки пыльцы непрерывно хаотически движутся. Беспорядочное движение взвешенных в жидкости очень маленьких частиц твердого тела и получило название броуновского движения. Было установлено, что броуновское движение происходит неограниченно долго. Интенсивность движения взвешенных в жидкости частиц не зависит от вещества этих частиц, а зависит от их размеров. Крупные частицы остаются неподвижными. Интенсивность броуновского движения увеличивается при повышении температуры жидкости и уменьшается при ее понижении. Взвешенные в жидкости частицы движутся под действием молекул жидкости, которые сталкиваются с ними. Молекулы движутся хаотично, поэтому силы, с которыми они действуют на взвешенные частицы, непрерывно изменяются по модулю и направлению. Это и приводит к беспорядочному движению взвешенных частиц. Таким образом, броуновское движение наглядно подтверждает существование молекул и хаотический характер их теплового движения. (Количественную теорию броуновского движения разработал в 1905 г. Эйнштейн.)
Диффузией называют явление самопроизвольного взаимного проникновения молекул граничащих между собой веществ в межмолекулярные промежутки друг друга. (Диффузию, происходящую через полупроницаемые перегородки, называют осмосом.) Примером диффузии в газах является распространение запахов. В жидкостях наглядным проявлением диффузии является перемешивание против действия силы тяжести жидкостей разной плотности (при этом молекулы более тяжелой жидкости поднимаются вверх, а более легкой — опускаются вниз). Диффузия происходит и в твердых телах. Это доказывает такой опыт: две отполированные плоские пластинки из золота и свинца, положенные друг на друга, выдерживались при комнатной температуре в течение 5 лет. За это время пластинки срослись, образовав единое целое, причем молекулы золота проникли в свинец, а молекулы свинца — в золото на глубину до 1 см. 1 Скорость диффузии зависит от агрегатного состояния вещества и температуры. С повышением температуры скорость диффузии возрастает, а с понижением — уменьшается. Размеры и масса молекул Размер молекулы является величиной условной. Его оценивают следующим образом. Между молекулами наряду с силами притяжения действуют и силы отталкивания, поэтому молекулы могут сближаться лишь до некоторого расстояния. Расстояние предельного сближения центров двух молекул называют эффективным диаметром молекулы и обозначают о (при этом условно считают, что молекулы имеют сферическую форму). За исключением молекул органических веществ, содержащих очень большое число атомов, большинство молекул по порядку величины имеют диаметр 10-10 м и массу 10-26 кг. Относительная молекулярная масса Поскольку массы атомов и молекул чрезвычайно малы, при расчетах обычно используют не абсолютные, а относительные значения масс, получаемые путем сравнения масс атомов и молекул с атомной единицей массы, в качестве которой выбрана 1/12 часть массы атома углерода (т. е. пользуются углеродной шкалой атомных масс). Относительной молекулярной (или атомной) массой Мr (или Аr) вещества называют величину, равную отношению массы молекулы (или атома) этого вещества к 1/12 массы атома углерода 12С. Относительная молекулярная (атомная) масса является величиной, не имеющей размерности. Относительная атомная масса каждого химического элемента указана в таблице Менделеева. Если вещество состоит из молекул, образованных из атомов различных химических элементов, относительная молекулярная масса данного вещества равна сумме относительных атомных масс элементов, входящих в состав данного вещества. Количество вещества Количество вещества, содержащегося в теле, определяется числом молекул в этом теле (или числом атомов). Поскольку число молекул в макроскопических телах очень велико, для определения количества вещества в теле сравнивают число молекул в этом теле с числом атомов в 0,012 кг углерода. Иными словами, количеством вещества v называют величину, равную отношению числа молекул (или атомов) N в данном теле к числу атомов NA в 12 г углерода, т. е. v = N/NA. Количество вещества выражают в молях. Моль равен количеству вещества системы, содержащей столько же структурных элементов (атомов, молекул, ионов), сколько содержится атомов в углероде-12 массой 0,012 кг. Постоянная Авогадро. Молярная масса Согласно определению понятия моль, в 1 моль любого вещества содержится одинаковое число молекул или атомов. Это число NA, равное числу атомов в 0,012 кг (т. е. в 1 моль) углерода, называют постоянной Авогадро. Молярной массой М какого-либо вещества называют массу 1 моль этого вещества Количество вещества можно найти как Массу одной молекулы можно найти как
|

 . Молярную массу вещества выражают в килограммах на моль.
. Молярную массу вещества выражают в килограммах на моль.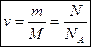
 или учитывая что относительная молекулярная масса числена равна массе одной молекулы выраженной в а.е.м. (1 а.е.м. = 1,66×10-27 кг).
или учитывая что относительная молекулярная масса числена равна массе одной молекулы выраженной в а.е.м. (1 а.е.м. = 1,66×10-27 кг).


