Особливості взаємодії нітратної кислоти з металами
Нітратна кислота - сильний окисник. Внаслідок взаємодії нітратної кислоти з металами водень не виділяється, оскільки відновлюється Нітроген, а не Гідроген. Нітроген відновлюється тим повніше, чим активніший метал і чим більше розведена кислота. Нітратна кислота не взаємодіє з золотом, платиною, платиновими металами, концентровану нітратну кислоту пасивують також залізо, хром, алюміній. При взаємодії з іншими металами (в залежності від активності метала та концентрації кислоти) утворюються сполуки Нітрогену з різними ступенями окиснення: NO2, NO, N2O, N2, NН3 або солі амонію.
Ме + HNO3 → Ме(NO3)n + Н2О + сполука Нітрогену
І. Благородні метали (Au, Pt, Os,Ir, Pd) з HNO3 не взаємодіють Ме + HNO3 → не реагують
ІІ. Малоактивні метали (Pb, Cu, Sn, Hg, Ag):
HNO3 + Me → Me(NO3)n + H2O + NO2 (конц.) 4 HNO3 + Cu = Cu(NO3)2 + 2 H2O + 2 NO2 (конц.) бурий газ
HNO3 + Me → Me(NO3)n + H2O + NO (розв.) 8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO (розв.) III. Метали середньої активності (Fe, Cr, Ni): HNO3 + Me → не реагують (конц.)
HNO3 + Me → Me(NO3)n + H2O + NO (розв.) N2O
4 HNO3 + Ni → Ni(NO3)2 + 4 H2O + 2 NO2 (розв.) 8 HNO3 + 3 Ni → 3 Ni(NO3)2 + 4 H2O + 2 NO (розв.) IV. Активні метали (Na, K, Ca, Mg, Zn): З концентрованою нітратною кислотою не взаємодіє алюміній.
a) HNO3 + Me → Me(NO3)n + H2O + (конц.) NO (конц. - 30%)
8 HNO3 + 3 Zn → 3 Zn(NO3)2 + 4 H2O + 2 NO (конц.)
б) HNO3 + Me → Me(NO3)n + H2O + (розв.) N2O
10 HNO3 + 4 Zn → 4 Zn(NO3)2 + 5 H2O + N2O
в) HNO3 + Me → Me(NO3)n + H2O + (сильно розв.) NH4NO3
10 HNO3 + 4 Zn → 4 Zn(NO3)2 + 3 H2O + NH4NO3
|

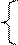 NO2
NO2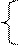 NO2 (конц. - 60%)
NO2 (конц. - 60%)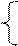 N2
N2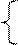 NН3
NН3


