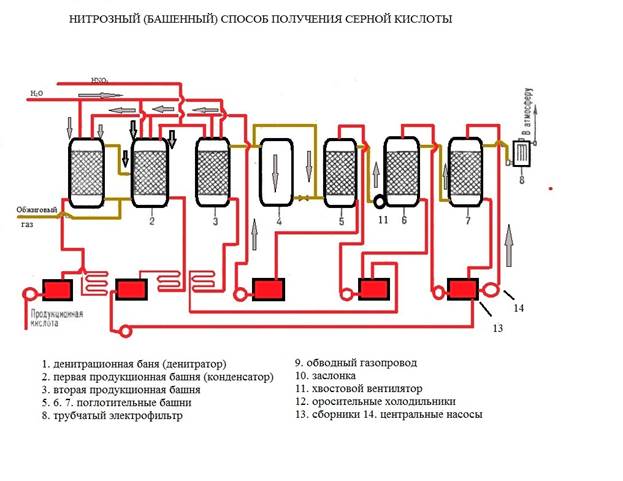
Схема производства серной кислоты нитрозным способом
Оксиды азота смешиваются H2SO4 с получением нитрозилсерной кислоты NO2 + H2SO4 = (NO) HSO4 + Н2О N2O3 + 2H2SO4 = 2(NO) HSO4 + Н2О Скорость взаимодействия N2O3 с H2SO4 выше чем у NO2, H2SO4 берут в избытке нитрозилсерная кислота растворяется в H2SO4 – этом раствор называют нитрозой. При взаимодействии SO2 с нитрозой в присутствии Н2О происходят следующие процессы: 1) образование сернистой кислоты: SO2 + Н2О= H2SO3 2) гидролиз нитрозил серной кислоты (NO) HSO4 + Н2О = H2SO4 + HNO2 3) образование серной кислоты: H2SO3+ HNO2 = H2SO4+ H2O + 2 NO
При окислении NO в окислительном объеме в зависимости от количества кислорода может образоваться NO2 или N2O3. Причем, N2O3 лучше поглощается серной кислотой. Превращение NO в NO2 и в N2O3 происходит в газовой фазе, поэтому процесс проводят в объемной полой башне. Скорость реакции увеличивается с повышением давления, но падает с повышением температуры. Например: при увеличении t от 0 до100˚С скорость процесса снижается в 3 раза. Затем оксиды азота поглощаются серной кислотой, осуществляется это в последних по ходу башнях, называемых абсорбционными. Получаемая нитроза направляется в продукционные башни.
Таким образом, NO2 и N2O3 возвращаются в процесс вновь и теоретически не должна расходоваться. Однако в производстве поглотить все оксиды азота без потерь не удается. Часть выходит с выхлопными газами в последней башне. Восполняются потери оксидов азота введение HNO3 в продукционную башню. На 1 т произведенной серной кислоты расход HNO3 составляет 10-20 кг в пересчете на 100% Корпуса башен изготовлены из листовой стали, внутри футерованы кислотоупорным материалом - андезитом. Размеры башни: h = 18м; d = 10 м количество башен от 4 до 7. печной газ может содержать 9% SO2, температура его 350˚С, J= 200кг/сут/м3. Для высокой интенсивности нитрозного производства необходимо: высококонцентрированной по содержанию SO2 обжиговый газ, крепкая нитроза: 8-11% оксидов азота, повышать t в продукционной башне и понижать t кислоты и газа в абсорбционной башнях, хорошая смачиваемость всей поверхности насадки при орошении.
Недостатки этого способа: - низкая концентрация полученной H2SO475-77% - высокое содержание примесей (Se, As, оксиды азота) -неполный возврат оксидов азота (добавление HNO3) Выбросы их вредны.
В настоящее время предпочтение отдается контактному способу производства, т.к. получается более чистая и концентрированная H2SO4 и олеум. Но еще достаточно много получают и башен H2SO4 на существующих установках. Особенно на суперфосфатных заводах.
|