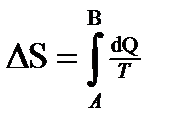ФИЗИЧЕСКИЕ ОСНОВЫ ТЕРМОДИНАМИКИ
· Связь между молярной (Cm) и удельной (с) теплоемкостями газа Cm=c M,где М — молярная масса газа. · Молярные теплоемкости* при постоянном объеме и постоянном давлении соответственно равны Cv= i R/2; C p =(i +2)R/2 где i — число степеней свободы; R — молярная газовая постоянная. · Удельные теплоемкости при постоянной объеме и постоянном давлении соответственно равны
· Уравнение Майера C р— Сv=R. · Показатель адиабаты
· Внутренняя энергия идеального газа U= N <e> или U= v Cv T, где <e>—средняя кинетическая энергия молекулы; N— число молекул газа; v — количество вещества. · Работа, связанная с изменением объема газа, в общем случае вычисляется по формуле
где V1 — начальный объем газа; V2 — его конечный объем. Работа газа: а) при изобарном процессе (p =const) A= p (V2 - V1); б) при изотермическом процессе (T =const)
* Здесь и далее в целях упрощения записи в индексах обозначений молярной теплоемкости при постоянном давлении и постоянном объеме букву «m» будем опускать.
в) при адиабатном процессе
где T 1 — начальная температура газа; T 2 — его конечная температура. · Уравнение Пуассона (уравнение газового состояния при адиабатном процессе)
· Связь между начальным и конечным значениями параметров состояний газа при адиабатном процессе:
· Первое начало термодинамики в общем случае записывается в виде Q=DU+A, где Q – количество теплоты, сообщённое газу; DU—изменение его внутренней энергии; А — работа, совершаемая газом против внешних сил. Первое начало термодинамики: а) при изобарном процессе
б) при изохорном процессе (A=0)
в) при изотермическом процессе (DU=0)
г) при адиабатном процессе (Q=0)
· Термический коэффициент полезного действия (КПД) цикла в общем случае
где Q1—количество теплоты, полученное рабочим телом (газом) от нагревателя; Q2—количество теплоты, переданное рабочим телом охладителю. КПД цикла Карно
где T 1 — температура нагревателя; T 2 — температура охладителя. · Изменение энтропии
где A и B — пределы интегрирования, соответствующие начальному и конечному состояниям системы. Так как процесс равновесный, то интегрирование проводится по любому пути. · Формула Больцмана S = k×ln W, где S — энтропия системы; W — термодинамическая вероятность ее состояния; k — постоянная Больцмана.
|

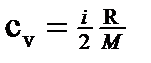 ,
,  .
.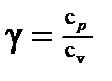 , или
, или 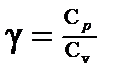 , или
, или 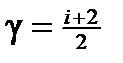 .
. ,
,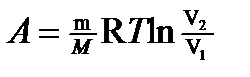 ;
;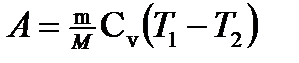 , или
, или 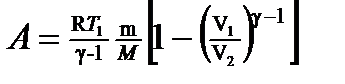 ,
,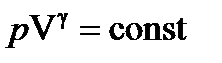 .
.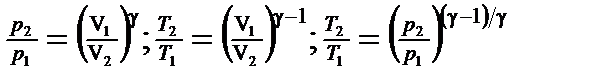 .
.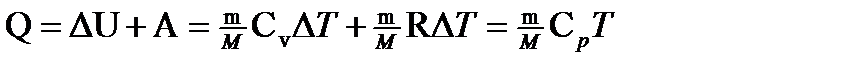
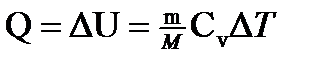 ;
;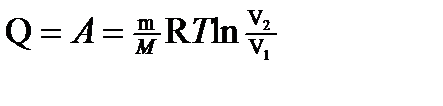 ,
,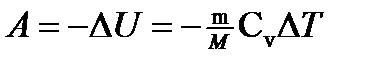 .
.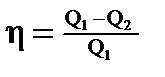 ,
,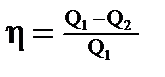 , или
, или 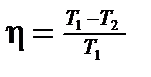 ,
,