ЗАКОНЫ ИДЕАЛЬНЫХ ГАЗОВ
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА МОЛЕКУЛЯРНОЕ СТРОЕНИЕ ВЕЩЕСТВА. ЗАКОНЫ ИДЕАЛЬНЫХ ГАЗОВ
· Количество вещества * тела (система) v = N / NA где N — число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему); NA — постоянная Авогадро: NA =6,02×1023 моль-1. · Молярная масса вещества M=m/ v, где m — масса однородного тела (системы); v — количество вещества этого тела. · Относительная молекулярная масса вещества
где ni — число атомов i -го химического элемента, входящего в состав молекулы данного вещества; A r, i — относительная атомная масса этого элемента. Относительные атомные массы приводятся в таблице Д. И. Менделеева. · Связь молярной массы М с относительной молекулярной массой M r вещества M= M rk, где k=10-3 кг/моль. · Молярная масса смеси газов
где m i — масса i -го компонента смеси; vi — количество вещества 1-го компонента смеси; k — число компонентов смеси. · Массовая доля ** i -го компонента смеси газов w i =m i /m, где m i — масса i -го компонента смеси; m — масса смеси. * Количество вещества — число структурных элементов (молекул, атомов, ионов и т. п), содержащихся в системе или теле. Количество вещества выражается в молях. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. ** Массовой долей компонента в смеси называется безразмерная величина, равная отношению массы компонента к массе смеси. · Уравнение состояния идеальных газов (уравнение Клапейрона — Менделеева)
где m — масса газа; М — его молярная масса; R — молярная газовая постоянная; Т — термодинамическая температура; v — количество вещества. · Закон Дальтона p = p 1+ p 2+…+ p k, где p — давление смеси газов; pi — парциальное давление i -го компонента смеси; k — число компонентов смеси.
|

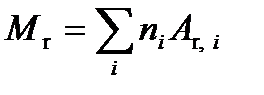 ,
,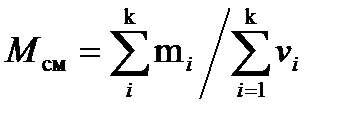 ,
,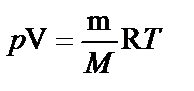 , или p V= v R T,
, или p V= v R T,


