Параметры молекулярных орбиталей и порядок связи для двухатомных молекул II периода
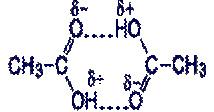
ВОДОРОДНАЯ СВЯЗЬ. Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920 г., для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н2O, Н2S, Н2Se, и Н2Te, они обратили внимание на то, что первый член этого ряда – вода – кипит намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 170° С ниже, чем наблюдаемая температура кипения. Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН3, Н3P, Н3As, Н3Sb. Истинная температура кипения аммиака равна –33 °С, что на 80 °С выше ожидаемого значения. При кипении жидкости разрушаются только Ван-дер-Ваальсовы силы взаимодействия, которые удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то это говорит о том, что молекулы чаще всего дополнительно связаны водородными связями. Водородная связь – зто связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы или между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом той же молекулы (внутримолекулярная водородная связь). Водородная связь возникает между электроотрицательными элементами Изображенная на схеме структура уксусной кислоты объясняет, почему молекулярный вес уксусной кислоты в паровой фазе достигает 120 (два молекулярных веса уксусной кислоты).
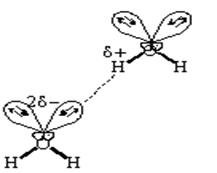
По своей природе водородная связь имеет смешанный электростатический и донорно - акцепторный характер. Электростатическая природа водородной связи, например, в воде, заключается в том, что атом водорода несет избыточный положительный заряд, а атом кислорода - избыточный отрицательный заряд. Электростатическое притяжение между избыточными зарядами атома водорода одной молекулы и атома кислорода другой способствует сближению молекул воды. Одновременно перекрывание электронных облаков одной неподеленной электронной пары кислорода и орбитали водорода другой молекулы воды способствует образованию ковалентной связи. В результате электронная плотность с атома кислорода одной молекулы частично перемещается на атом водорода O-H связи другой. В этом и заключается донорно-акцепторный характер водородной связи. Водородная связь может возникнуть между двумя разными молекулами, например, между молекулами воды и спирта: Н – О С2Н5
|






 ;
;


