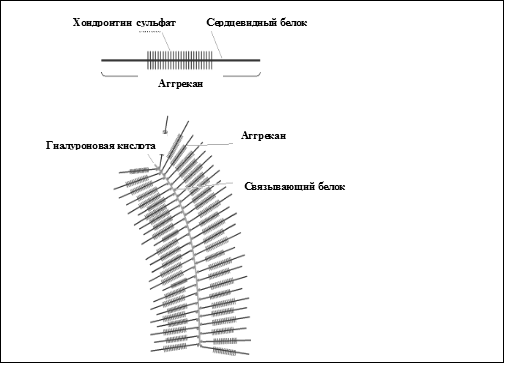
Основной протеогликан хрящевого матрикса называется агрекан, он составляет 10% по весу исходной ткани и 25% сухого веса хрящевого матрикса. Это очень большая молекула, в которой к одной полипептидной цепи присоединены до 100 цепей хондроитинсульфатов и около 30 цепей кератансульфатов. По форме молекула агрекана напоминает бутылочный «ёршик».
В хрящевой ткани молекулы агрекана собираются в агрегаты с гиалуроновой кислотой и небольшим связывающим белком. Оба компонента присоединяются к агрекану нековалентными связями в области домена G1. Домен G1 взаимодействует примерно с пятью дисахаридными единицами гиалуроновой кислоты, далее этот комплекс стабилизируется связывающим белком; домен G1 и связывающий белок вместе занимают 25 дисахаридных единиц гиалуроновой кислоты. Конечный агрегат с молекулярной массой более 200·106 Д состоит из одной молекулы гиалуроновой кислоты и 100 молекул агрекана (и такого же количества связывающего белка).
|
| Рис. 1.6Протеогликан.
|
Координация сборки этих агрегатов является центральной функцией хондроцитов. Агрекан и связывающий белок продуцируются этими клетками в необходимых количествах. Эти компоненты могут взаимодействовать друг с другом внутри клетки, но процесс агрегации полностью завершается в межклеточном матриксе. Показано, что гиалуроновая кислота образуется на поверхности хондроцитов специфической синтетазой и «выталкивается» в межклеточное пространство, чтобы связаться с агреканом и связывающим белком. Созревание функционально активного тройного комплекса составляет около 24 ч.
Катаболизм агрекана изучен в настоящее время недостаточно. Имеются данные о наличии в хрящевом межклеточном матриксе фермента агреканазы. Местом действия этого фермента является интерглобулярная область между доменами G1 и G2. Кроме того, в зоне присоединения цепей хондроитинсульфата в коровом белке имеются ещё 3 места протеолитического расщепления агрекана. Конечный продукт расщепления агрекана представляет собой комплексдомена G1, связывающего белка и гиалуроновой кислоты. Он поступает в хондроцит по механизму эндоцитоза и подвергается расщеплению лизосомальными гидроксилазами. При пародонтите происходит увеличение активности ферментов, участвующих в деградации протеогаиканов. Возрастает активность катепсина D, гиалуронидазы, β -D-глюкуронидазы, арилсульфатазы.





