НЕКОЛЛАГЕНОВЫЕ БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ.
Фибронектин Фибронектин – это гликопротеин экстрацеллюлярного матрикса, который синтезтруется большинством клеток соединительной ткани.
Фибронектин состоит из двух сходных, но не идентичных субъединиц, молекулярная масса которых составляет ~250 000. Каждая субъединица содержит девять различных в функциональном отношении областей, включающих два фибронектин-связывающих сайта, два гепарин-связывающих сайта и по одному связывающему сайту для желатина, коллагена, ДНК и клеточных поверхностей. Фибронектин кодируется одним геном, состоящим из ~50 экзонов (в зависимости от вида животного), который локализуется на 7 хромосоме у человека. Тем не менее, в результате различных видов сплайсинга было идентифицировано около 20 разновидностей мРНК, содержащих 7,5 тыс. пар нуклеотидов. Субъединицы молекулы фибронектина состоят из трех разных типов повторяющихся последовательностей. Повторы I и II типа кодируются каждый одним экзоном и характеризуются петлевидными растяжениями, расположенными между аминокислотами в положениях 45 и 50 и связанными дисульфидными мостиками. Повторы I и II типа локализуются в амино- и карбокситерминальных субъединицах, тогда как повтор III типа находится в центральной части. Повторы III типа кодируются парой экзонов и характеризуются наличием петель, состоящих из 90 аминокислот. В десятом повторе III типа наблюдается измененная последовательность GRGDS - прототип последовательности для прикрепления клеток. Существует и другая последовательность, способствующая прикреплению клеток, но отличающаяся от RGD. В составе субъединиц были идентифицированы три области: EIIIA, ЕIIIВ и V, при удалении или вставке которых (полностью иди частично), образуются различные типы фибронектина. Клеточный фибронектин состоит из разных комбинаций EIIIA и ЕIIIВ областей в зависимости от вида клеток. Пока точные функции этих областей не определены, но предполагается, что EIIIA и ЕIIIВ участвуют в процессе организации матрикса. Фибронектин участвует в адгезии клеток, контролирует их морфологию и архитектуру поверхности, а также формирует фибриллы внеклеточного матрикса. Фибронектин связывает клетки с компонентами внеклеточного матрикса, в частности с коллагеном и гликозаминогликанами. При заживлении ран фибронектин образует пути для миграции клеток. Рецептор фибронектина - интегрин, встроен в клеточную мембрану. Внутри клетки интегрин взаимодействует с актиновыми микрофиламентами примембранного цитоскелета, а снаружи соединяется с фибронектином. В свою очередь фибронектин образует связи с коллагеном и гликозаминогликаном (гепарансульфат). Так устанавливается структурная непрерывность между цитоскелетом и внеклеточным матриксом. Таким образом, фибронектин участвует в интеграции межклеточного матрикса и в адгезии клеток соединительной ткани. Ламинин
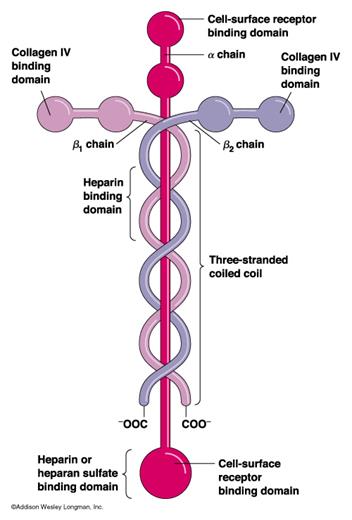
Ламинин – это гликопротеин, наиболее распространенный в базальных мембранах. Состоит из 3 полипептидных цепей, которые сначала скручены вместе, а затем 2 расходятся под углом 90 градусов, так, что образуется крест. Ламинин содержит несколько глобулярных и стержневых доменов, с центрами связывания для компонентов базальных мембран: коллагена IV типа, нидогена, фибронектина, клеток. Ламинин не просто связывает клетки, но модулирует клеточное поведение. Он регулирует рост, дифференцировку, подвижность, морфологию клеток. Нидоген Нидоген – этосульфатированный гликопротеин базальных мембран. Он состоит из одной полипептидной цепи, скрученной в 3 глобулярных домена. Один из них может связываться с ламинином, один – с коллагеном IV типа. При этом формируется комплекс ламинин-нидоген-коллаген. В ЭЦМ разных видов соединительной ткани находится также значительное количество неколлагеновых белков, участвующих в процессах интеграции и адгезии, а также выполняющих специфические функции
|