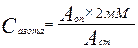Низкомолекулярные компоненты ротовой жидкости и методы их определения.
Азотсодержащие метаболиты в ротовой жидкости. Опыт № 1. Открытие мочевины. Мочевина, диамид угольной кислоты, является основным конечным продуктом белкового обмена у млекопитающих. Мочевина образуется в гепатоцитах в результате орнитинового цикла и поступает в кровь, где ее концентрация составляет 3,3 - 6,7 ммоль/л. Повышение содержания моневины в крови обозначается как уремия (правильнее гиперуремия) и указывает на наличие дисфункции почечной ткани, хронической почечной недостаточности. Содержание мочевины в ротовой жидкости по данным различных авторов составляет от 20 до 70% от уровня ее в крови. Столь значительный разброс данных связан с действием фермента бактерий ротовой жидкости уреазы, которая гидролизует мочевину, согласно реакции: NHxCONH2 + Н20 = С02 + 2 NH3 Таким образом, для определения мочевины необходимо брать только что собранную слюну. При хранении образцов слюны уровень мочевины в них снижается. Есть данные, что при хронической почечной недостаточности содержание мочевины в ротовой жидкости повышается (Баранникова, Храмов, Гаврикова, Л.М.,Коваль А.А). Техника выполнения. К 0,2 мл свежей слюны добавляется 1,0 мл воды, 0,2 мл 1%-ного спиртового раствора диметилглиоксима и 1,0 мл 25%-ного раствора серной кислоты, содержащий25 мг % тиосемикарбазида;проба хорошо перемешивается и ставится в кипящую водяную баню на 20 мин. При наличии мочевины развивается пурпурное окрашивание. Пробы колориметрируются при 540 нм. Для количественного определения мочевины готовится стандартный I ммоль/л раствор мочевины. Количество мочевины рассчитывают по формуле:
Опыт № 2. Определение суммарного значения азота аминокислот. Суммарное содержание в ротовой жидкости аминосоединений, дающим цветную реакцию с нингидрииом, находится на уровне 2-3 ммоль/л. Техника выполнения. Для анализа достаточно 0,1-0,2 мл смешанной слюны, к которой добавляется 2 мл воды и 0,2 мл 0,5%-ного раствора нингидрина. Проба нагревается не менее 10 мин в хорошо кипящей водяной бане. Развивающееся сине-фиолетовое окрашивание после охлаждения пробы колориметрируют при 400 нм. В качестве калибровочного раствора используется 2 ммоль/л раствор глицина. Количество суммарного значения азота аминокислот рассчитывают по формуле:
В таблице приводятся данные содержания некоторых аминокислот в ротовой жидкости и плазме крови человека Таблица 6.1 Концентрация аминосоединений в слюне и плазме
Как видно из таблицы уровень отдельных аминокислот в ротовой жидкости, как правило, ниже чем в плазме крови за исключением глутаминовой кислоты. Но самое интересное это многократно повышенное количество путресцина, что свидетельствует об активности в ротовой жидкости фермента орнитиндекарбоксилазы. Определение аминоазота в крови имеет ограниченное диагностическое значение: гипоаминоацидемия наблюдается при голодании, гиперфункции коры надпочечников, ревматоидном артрите. Повышение содержания аминокислот в крови отмечено при обезвоживании, хронической почечной недостаточности, гемолизе и т.п. Что касается аминоазота в ротовой жидкости, то его повышение следует ожидать при усилении протеолитических процессов в ротовой полости, что является следствием воспалительных и деструктивных процессов в полости рта. Таким образом, данный анализ может быть полезен для решения проблем стоматологии. Опыт № 3. Цветная реакция Чинарда К 0,2 мл ротовой жидкости добавляется I mл ледяной уксусной кислоты и 0,1 мл 2,5%-ного раствора нингидрина в смеси фосфорной и уксусной кислоты. Проба перемешивается и нагревается в водяной бане в течение 15 мин. При наличии в образцах пролина и орнитина развивается красно-коричневое окрашивание. Поскольку в смешанной слюне содержатся, так называемые, белки богатые пролином (РRР), можно ожидать, что усиленный гидролиз этих слюнных белков приведет к заметному увеличению уровня пролина в ротовой жидкости. Опыт № 4. Цветная реакция Паули Объемы ротовой жидкости в 0,1 мл дают заметную диазореакцию Паули, что свидетельствует о присутствии в слюне имидазольных. соединений (главным образом, аминокислота гистидин), а также тирозина. В нашей модификации реакция Паули выполняется следующим образом. Техника выполнения. Образец ротовой жидкости разбавляется до 2 мл дистиллированной водой и к нему последовательно добавляется по 0,1 мл 1% - ногораствора сульфаниловой кислоты, 0,5%-ного раствора нитрита натрия и немного позже 0,1 мл 20%-ного раствора карбоната натрия. Развивается оранжевое окрашивание, которое сразу же колориметрируется при 490 нм против холостой пробы (без слюны). В слюне содержатся специфические белки с высоким содержанием гистидина, таких белков идентифицировано не менее семи (один из них содержит 319 остатков гистидина на 1000 аминокислотных остатков). Кроме того, в слюне найден белок с высоким содержанием тирозина, так называемый, статерин. Однако, как показал хроматографический анализ, диазореакция Паули развивается, в основном, за счет присутствия в ротовой жидкости гистидина и его производных. Интересно, что диазореакция Паули развивается не только со смешанной слюной, но и с муциновым осадком. Как и реакция Чинарда, диазореакция Паули свидетельствует о протеолизе в ротовой полости. Реакции можно рассматривать как показатели дисбактериоза в ротовой полости и в этой связи они представляют интерес для практической стоматологии. Опыт № 5. Определение содержания аммиака в ротовой жидкости В ротовой жидкости уровень аммиака составляет 1,1 - 12,3 ммоль/л, т.е. в 100-400 раз выше, чем в крови. Столь высокое содержание аммиака является следствием метаболических процессов в ротовой полости, в частности микробы слюны быстро гидролизуют мочевину и, по-видимому, глутамин с образованием аммиака. Аммиак используется микробами полости рта для синтеза аминокислот, белков и др. азотистых продуктов. Как повышение уровня аммиака слюны, так и его понижение указывают на явления дисбактериоза в ротовой полости. Санация полости рта и подавление роста особенно уреазо-позитивных бактерий должно однозначно вести к снижению уровня аммиака ротовой жидкости. Техника выполнения. По модификации реакции Бертло, для анализа требуется не более 0,05 мл ротовой жидкости. К образцу прибавляется I мл дистиллированной воды и по I мл 5%-ного водного раствора фенола с добавлением 25 мг%нитропруссида натрия и раствор гипохлорита натрия (готовится из коммерческого стирального средства "Белизна" разведением в 20 раз). После добавления гипохлорита проба перемешивается и ставится на 5 мин в теплую водяную баню. Развивается синее окрашивание (индофенол), которое колориметрируется при 590 нм. Обязательно требуется постановка слепого опыта "вода + реактивы" для компенсации аммиака в воде и реактивах. Для пересчета на на микромоли аммиака в слюне строится калибровочный график с 0,001 молярным раствором хлорида аммония. Данная цветная реакция может использоваться для анализа активности ряда ферментов (уреаза, аспарагиназа и т.п.). Опыт № 6. Определение нитритов в ротовой жидкости. С пищей человек получает некоторое количество азотнокислых солей, особенно высокое содержание нитратов отмечено в зеленных культурах, капусте, свекле. В ротовой полости и вообще в желудочно-кишечном тракте активно идут процессы восстановления нитратов до нитритов и далее до аммиака. Эту реакцию катализируют ферменты анаэробных микробов нитрат- и нитритредуктазы. В отличие от относительно безвредных нитратов образующиеся из них нитриты следует отнести к токсическим продуктам; в кислой среде (желудок) образующиеся в ротовой полости нитриты могут участвовать в синтезе канцерогенов нитрозаминов. В качестве естественных вторичных аминов, необходимых для синтеза нитрозаминов, могут выступать пролин и оксипролин, образующиеся при гидролизе пищевых белков. Техника выполнения. Для определения нитритов в ротовой жидкости к 0,5 мл последней добавляется 2,5 мл воды и 1 мл 1%-ного коммерческого реактива Грисса, приготовленного на 20%-ной уксусной кислоте. Пробы перемешиваются, инкубируются 5 минут в кипящей водяной бане, охлаждаются, центрифугируются 3-5 мин при 12000 об/мин. Прозрачные супернатанты колориметрируются при 540 нм против пробы, в которую слюна не добавлялась (слепой опыт), для построения калибровочной кривой используются разведение 0,002 молярного раствора нитрида натрия. Уровень нитритов в ротовой жидкости значительно зависит от пищевых нитратов. В пробах слюны натощак нитриты не определялись, тогда как после приема пищи, особенно овощей, достигались величины порядка 1,5 - 2,0 ммоль/л слюны. Содержание нитритов в сыворотке крови здоровых людей находится на уровне 1 - 9,4 мкмолей/л, т.е. почти в 1000 раз ниже, чем в слюне. Величины нитритов в ротовой жидкости и особенно активность в ней микробных нитратредуктаз являются отражением качественного и количественного состава микробной флоры ротовой полости.
Метаболиты углеводного обмена в ротовой жидкости Опыт № 7. Определение молочной кислоты В норме в артериальной крови содержится 0,5 - 1,6 ммоль/л лактата, в венозной до 2,2 ммоль/л. При мышечной работе уровень лактата крови повышается в три и более раза. Таким образом, определение лактата представляет интерес для спортивной медицины как объективный индекс интенсивности тренировок. В клинической практике лактат крови интересен как показатель гипоксии при сердечной и легочной недостаточности, анемии. В ротовой жидкости концентрация молочной кислоты заметно колеблется. Нормальные величины в пределах от 1,2 до 8,5 ммоль/л. При физических нагрузках лактат ротовой жидкости повышается до 21 ммоль/л. Отмечена корреляция между содержанием лактата в крови и ротовой жидкости, что свидетельствует о целесообразности анализа молочной кислоты в ротовой жидкости. К сожалению, источником слюнного лактата могут быть и процессы анаэробного гликолиза непосредственно в ротовой полости, однако интенсивность этих процессов определяется присутствием в ротовой жидкости соответствующих субстратов (глюкозы). Техника выполнения (реакция Берга). К 0,5 мл ротовой жидкости (лучше использовать центрифугат) добавить 0,05 мл 1%-ного раствора хлорида железа (III).и довести до 2,5 мл водой, чтобы пробу можно было колориметрировать. Образец колориметрируется при 400 нм против холостой пробы.
|