Уравнение состояния
Параметры p, V, T связаны между собой функциональной зависимостью f (p, V, T) = 0, которая называется характеристическим уравнением состояния рабочего тела. Характеристическое уравнение состояния имеет большое значение в термодинамике. Это уравнение позволяет определить один из параметров состояния по известным двум другим. Для большинства реальных рабочих тел аналитическая зависимость между параметрами состояния достаточно сложна и воспользоваться ею для определения параметров состояния в ряде случаев бывает затруднительно. Наиболее простое уравнение состояния может быть получено для идеального газа, под которым будем понимать газ, в котором отсутствуют силы межмолекулярного взаимодействия и объём молекул исчезающе мал по сравнению с объемом газа. При этом молекулы представляют собой материальные точки. Заметим, что зачастую реальные газы ведут себя как идеальные. Характеристическое уравнение состояния идеального газа может быть представлено в виде:
В приведенных уравнениях: р – абсолютное давление, Н/м2; V – полный объем газа, м3; M – масса газа, кг; T – абсолютная температура, К; R – газовая постоянная, Дж/кг×К, зависящая от природы газа. Приведенное выше уравнение может быть записано для 1 моля газа, которое называют уравнением Клайперона-Менделеева:
Величина
Газовая постоянная для газа может быть вычислена по формуле:
где μ – молекулярная масса.
|

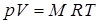 .
.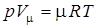 .
.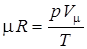 является постоянной для 1 кмоля любого газа во всех состояниях и называется поэтому универсальной газовой постоянной. Универсальная газовая постоянная может быть легко вычислена при нормальных физических условиях:
является постоянной для 1 кмоля любого газа во всех состояниях и называется поэтому универсальной газовой постоянной. Универсальная газовая постоянная может быть легко вычислена при нормальных физических условиях: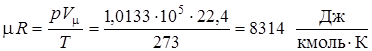 .
. ,
,


