Теплоемкость
При нагревании или охлаждении разлитых тел происходит изменение их температуры. Для различных тел изменение температуры различно и зависят от их свойств. Под теплоемкостью будем понимать количество тепла, сообщенного единице количества вещества для изменения его температуры на 1 К. Различают массовую, объемную и мольную теплоемкость. Под массовой теплоемкостью С, кДж/кг×К понимают количество тепла, сообщенного 1 кг вещества для изменения его температуры на 1 К. Под объемной С', кДж/м3×К теплоемкостью понимают количество тепла, сообщенное 1 м3 вещества при нормальных условиях для изменения его температуры на 1 К. Под мольной μ C, кДж/кмоль×К теплоемкостью понимают количество тепла, сообщенное 1 кмолю вещества для изменения его температуры на 1 К. Между этими теплоемкостями существует определенная связь:
Теплоемкость рабочего тела зависит от температуры С = f (t). Среднее значение теплоемкости в заданном интервале температур t 1 – t 2 может быть представлено
Как будет показано в дальнейшем, величина теплоемкости зависит от характера протекания термодинамического процесса. Большое значение в термодинамике имеют значения теплоемкости изобарного Ср и изохорного Сv процессов. Отношение Молекулярно-кинетическая теория строения вещества позволяет определить приближенно мольные, изобарные и изохорные теплоемкости идеального газа в зависимости от его атомности, табл. 2. Таблица 2
Итак, теплоемкость зависит от природы тела, температуры, давления, характера протекания процесса. По теплоемкости и разности температур можно определись количество тепла, участвующее в процессе p = const Q = MCp Δ T; Q = VC'p Δ T; Q = n μ Cp Δ T; Для идеальных газовых смесей массовая и объемная теплоемкости могут быть представлены в виде:
|

 ;
; 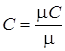 ;
;  .
. .
.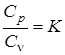 – называют показателем адиабаты.
– называют показателем адиабаты. .
. .
.


