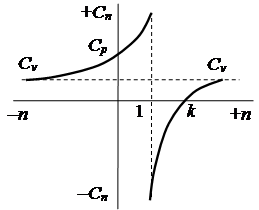Политропные процессы
До сих пор рассмотрены процессы, имеющие какой-то постоянный признак – постоянный объем, давление, температуру, отсутствие теплообмена с окружающей средой. Наряду с этими процессами существует бесчисленное множество процессов, имеющих другие постоянные признаки. Принято считать любой процесс идеального газа, проходящий при постоянной Сп теплоемкости – политропным. Таким образом, все рассмотренные ранее процессы являются политропными. Политропа может быть описана уравнением pVn = const, где п – показатель политропы, являющийся постоянной величиной для данного процесса. Если положить в уравнение политропы получим: п = 0 р = const – изобарный процесс; п ® ±¥ V = const – изохорный процесс; п = 1 pV = const – изотермический процесс; п = k pVk = const – адиабатный процесс. Следовательно, показатель политропы изменяется в пределах от –¥ до +¥. 2)
    
Рис. 13
3) Изменение параметров состояния аналогично изменению их в адиабатном процессе при замене показателя адиабаты К показателем политропы п
4) Изменение внутренней энергии и энтальпии Δ U = U 2 – U 1 = Cvm (T 2 – T 1); Δ i = i 2 – i 1 = Cpm (T 2 – T 1). 5) Изменение энтропии и изображение процесса в T-S координатах
где 6) Работа изменения объема Формулу для расчета работы политропного процесса можно получить аналогично формуле работы адиабатного процесса.
7) Теплота процесса
8) Теплоемкость Подставим в уравнение I закона значение величин q, Δ U, l
или
После упрощения, получим уравнение теплоемкости политропного процесса
Полученное уравнение может быть преобразовано путем подстановки величины газовой постоянной из уравнения Майера
Величина теплоемкости политропного процесса зависит от значения показателя политропы. Для основных термодинамических процессов можно получить при: п = 0, Сn = CvK = Cp – изобарную теплоемкость; п ® ±¥, п = 1, Сn ® ¥ – теплоемкость изотермического процесса; п = k, Сn = 0 – теплоемкость адиабатного процесса.
Характер зависимости теплоемкости политропного процесса от показателя политропы может быть представлен графически. Смысл отрицательной теплоемкости можно пояснить следующим образом: работа изменения объема рабочего тела большое подведенной теплоты, а по q = Δ U + l на работу затрачивается часть внутренней энергии, следовательно, температура уменьшается.
|

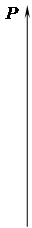
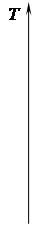




 ;
; 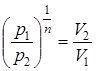 ;
; 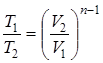 ;
; 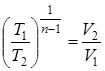 ,
,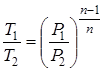 ;
;  .
. ,
, – теплоемкость политропного процесса.
– теплоемкость политропного процесса. .
.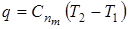 .
.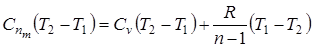
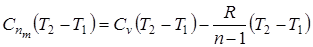 .
.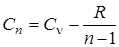 .
.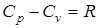 ;
;  ;
; 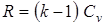 ;
; .
.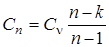 .
.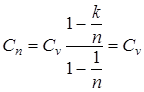 – изохорную теплоемкость;
– изохорную теплоемкость;