Адиабатный процесс. Процесс, протекающий без теплообмена с окружающей средой, называется адиабатным
Процесс, протекающий без теплообмена с окружающей средой, называется адиабатным. В адиабатном процессе δ q = 0; q = 0. Получим уравнение адиабаты Первый закон термодинамики dU + δ l = 0 Cv dT + p dV = 0. (13) Продифференцируем характеристическое уравнение состояния pdV + Vdp = RdT, откуда dT = Подставим значение dT в уравнение (13)
Преобразуем приведенное выражение
Разделив переменные и проинтегрировав (14), получим:
Рис. 12 3) Зависимость между параметрами состояния рабочего тела
4) Вычисление изменения внутренней энергии и энтальпии Δ U = U 2 – U 1 = Cvm (T 2 – T 1). Δ i = i 2 – i 1 = Cpm (T 2 – T 1). 5) Изменение энтропии и изображение процесса в T-S координатах: dS = В адиабатном обратимом процессе изменение энтропии не происходит. Поэтому адиабатный процесс называют изотропным. 6) Работа изменения объема l = 7) Теплота процесса δ q = 0; q = 0. 8) Аналитическое выражение I закона термодинамики. Работа совершается за счет изменения внутренней энергии l = –Δ U = U 1 – U 2.
|

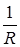 (pdV + Vdp).
(pdV + Vdp).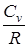 (pdV + Vdp) + pdV = 0.
(pdV + Vdp) + pdV = 0.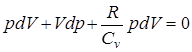 ;
; 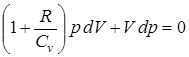 .
.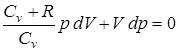 ;
;  .
.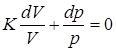 ;
; 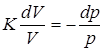 ;
;  .
. ; откуда
; откуда 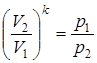 или
или  .
.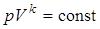 . (15)
. (15) 2)
2) ;
; 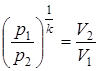 .
.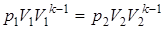 ;
; 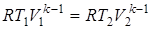 .
.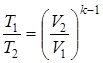 ;
; 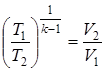 ;
; 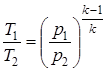 ;
; 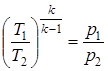 .
.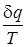 ; δ q = 0; dS = 0; Δ S = S 2 – S 1 = 0.
; δ q = 0; dS = 0; Δ S = S 2 – S 1 = 0. .
.


