Некоторые понятия химической термодинамики
Раздел 1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
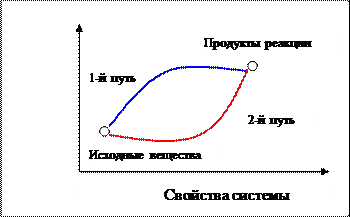
В самом общем виде химический процесс может быть представлен в следующем виде: a А + b B <══> d D + e E, где А и В ─ исходные вещества; D и E ─ продукты процесса (конечные вещества); a, b, d, e ─ стехиометрические коэффициенты. Основные закономерности протекания химических процессов рассматриваются в темах: ▪ химическая термодинамика; ▪ химическая кинетика; ▪ химическое равновесие. Некоторые понятия химической термодинамики Термодинамическая система ─ тело или группа тел, находящихся во взаимодействии и мысленно выделяемых из окружающего материального пространства. Между отдельными частями термодинамической системы, а также между системой и окружающей средой происходит обмен энергией. Гомогенная система не имеет внутри себя поверхностей раздела, отделяющих друг от друга различные по свойствам части системы. В гетерогенных системахтакие поверхности раздела есть. Изолированная системаимеет постоянный объём и не обменивается с окружающей средой ни веществом, ни энергией. Совокупность всех химических и физических свойств системы (например): ▪ Т – температуры; ▪ р – давления; ▪ V – объёма; ▪ ν; – количества вещества; ▪ с – концентрации реагирующих веществ характеризует её состояние. При переходе системы из одного состояния в другое происходит термодинамический процесс, и изменяются свойства системы. Термодинамические свойства системы выражаются через характеристические функции состояния системы: ▪ U – внутренняя энергия; ▪ H – энтальпия; ▪ S – энтропия; ▪ G – энергия Гиббса (изобарно-изотермический потенциал). Их величина зависит от природы и количества вещества, температуры, давления. Характеристические функции состояния (U, H, S, G) обладают тем общим свойством, что их изменение (Δ f) не зависит от пути процесса, а зависит от начального и конечного состояния системы (рис. 1.1): Δ f состояния процесса = f состояния конечных веществ ─ f состояния начальных веществ. (1.1) (продуктов реакции) (исходных веществ)
|