ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
61. Вычислить изменение стандартных энтальпий
62. Вычислить стандартную энтальпию образования СО(г), если известно, что для реакции
Определить величину стандартной энтропии этой реакции. 63. Вычислить
64. Возможен ли переход воды из жидкого состояния в газообразное? Если да, то чему равно изменение стандартной энтальпии и стандартной энтропии при переходе воды из жидкого состояния в газообразное? 65. Определить, возможно ли протекание реакций:
Вычислить изменение стандартной энтропии. 66. Как можно объяснить значительное различие в изменении энтропии для реакций:
Какой знак имеет величина изменения энтальпии в этих реакциях? 67. Не проводя расчета, определить качественно, в каких химических реакциях величина изменения энтропии будет уменьшаться, увеличиваться или приближаться к нулю:
68. Определить свободную энергия Гиббса: а) используя величины изменения энтальпии и энтропии следующих реакций:
и б) используя величины 69. Определить направление протекания следующих реакций:
70. Пользуясь теплотами образования, рассчитать тепловой эффект следующих реакций в стандартных условиях:
Определите, экзо- или эндоэффект сопровождает образование продуктов этих реакций. 71. Рассчитать энтальпию образования 72. Рассчитать изменение энергии Гиббса для следующих реакций по известным значениям
Возможно ли осуществление этой реакции при 298 К? Какой фактор – энтальпийный или энтропийный – определяет знак 73. Вычислить изменение энергии Гиббса при 25 и 1000 0С для реакции
Влиянием температуры на изменение энтальпии и энтропии пренебречь. 74. Вычислить значения
Как влияет температура на направление рассматриваемого процесса? 75. Возможно ли протекание следующих реакций при стандартных условиях и при высоких температурах:
76. При восстановлении 40 г оксида железа (III) алюминием выделяется 213, 15 кДж тепла. При сгорании 2,7 г металлического алюминия выделяется 83,6 кДж тепла. На основании этих данных вычислить энергию образования оксида железа (III). 77. Исходя из значений стандартных теплот образования, стандартных энтропий соответствующих веществ, вычислить 78. Почему энтальпия нейтрализации сильных кислот и оснований одинакова для различных кислот и оснований, а энтальпия нейтрализации слабых кислот и оснований зависит от природы реагирующих веществ? Покажите на примерах. 79. При взаимодействии газообразных метана и сероводорода образуются сероуглерод CS2(г) и водород. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. 80. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака (н.у.)?
|

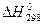 и стандартных изменений энтропий
и стандартных изменений энтропий  для реакции:
для реакции: ,
,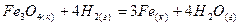 ,
, .
.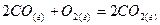
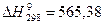 кДж.
кДж.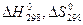 для реакций:
для реакций: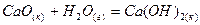 ,
, .
. ,
, .
. ,
,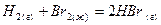 .
. ,
, ,
,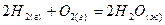 ,
, ,
, ,
, ,
,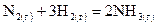 .
.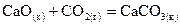 ,
, .
. .
.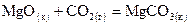 ,
,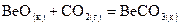 .
.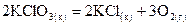 ,
,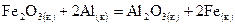 .
. , если теплота разложения по реакции
, если теплота разложения по реакции  составляет +98,03 кДж/моль.
составляет +98,03 кДж/моль.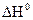 ,
, 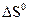 при 25 0С:
при 25 0С: ,
, 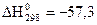 кДж/моль,
кДж/моль,  Дж/моль×град.
Дж/моль×град.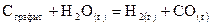 ,
, 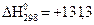 кДж/моль,
кДж/моль,  Дж/моль·град.
Дж/моль·град. ,
, 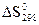 и
и  .
.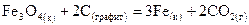 ,
, ?
?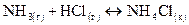 . Может ли эта реакция протекать самопроизвольно при стандартных условиях?
. Может ли эта реакция протекать самопроизвольно при стандартных условиях?


