ХИМИЧЕСКОЕ РАВНОВЕСИЕ
101. При 75°C реакция протекает за 8 минут. Если температурный коэффициент равен 3,0, то какое время необходимо для проведения реакции при 200°C? 102. Изменится ли константа скорости реакции при: 1) замене одного катализатора другим; 2) изменении концентраций реагирующих веществ? 103. Для какой реакции энергия активации больше (прямой или обратной), если прямая реакция идёт с выделением тепла? 104. Чему равна энергия активации реакции, если при повышении температуры от 298 до 303 К скорость её повысилась в два раза? 105. Каково значение энергии активации реакции, скорость которой при 308 К в десять раз больше, чем при 298 К? 106. Реакция 2H2(г)+O2(г)Þ2H2O(г) протекает с выделением тепла. Но для того чтобы реакция началась, исходную смесь нагревают. Почему нужен нагрев? 107. В закрытом сосуде установилось равновесие: CO2(г)+H2(г)ÛCO(г)+H2O(г). Константа равновесия равна единице. Определить, сколько молей CO2(г) (в %) подвергается превращению в CO при определённой температуре, если смешать 2 моля CO2 и 10 молей H2? 108. При состоянии равновесия в системе N2(г)+3H2(г)Û2NH3(г), DH0=45,2 кДж/моль. Концентрации участвующих в реакции веществ составляют: 109. Константа равновесия реакции FeO(к)+CO(г)ÛFe(к)+CO2(г) при некоторой температуре равна 1. Найти равновесные концентрации CO и CO2, если начальные концентрации этих веществ составляют: 110. Равновесие в системе H2(г)+I2(г)Û2HI(г) установилось при следующих концентрациях: 111. Реакция CO + Cl2 Û COCl2 протекает в закрытом сосуде при постоянной температуре; исходные вещества взяты в эквивалентных количествах. К моменту наступления равновесия остаётся 50% начального количества CO. Определить давление равновесной газовой смеси, если первоначальное давление равнялось 100 кПа (750 мм.рт.ст.). 112. Найти константу равновесия реакции N2O4 Û 2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% N2O4. 113. При некоторой температуре равновесие в системе 2NO2 Û 2NO + O2 установилось при следующих концентрациях: [NO2] = 0,006 моль/л; [NO] = 0,024 моль/л. Найти константу равновесия реакции и исходную концентрацию диоксида азота. 114. В замкнутом сосуде протекает реакция AB(г.) Û A(г.) + B(г.). Константа равновесия реакции равна 0,04, а равновесная концентрация вещества B составляет 0,02 моль/л. Найти начальную концентрацию вещества AB. Сколько процентов вещества A разложилось? 115. Реакция между веществами A и B количественно описывается уравнением: A + 2B ® C. Начальные концентрации составляют: [A]0 = 0,03 моль/л, [B]0 = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества A уменьшится на 0,01 моль/л.
|

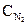 =1,5 моль/л,
=1,5 моль/л,  =4,5 моль/л,
=4,5 моль/л, 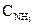 =2,0 моль/л. Определить исходные концентрации H2 и N2.
=2,0 моль/л. Определить исходные концентрации H2 и N2. =0,1 моль/л,
=0,1 моль/л, 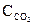 =0,02 моль/л.
=0,02 моль/л. =0,01 моль/л,
=0,01 моль/л,  =0,18 моль/л. Определить исходные концентрации иода и водорода.
=0,18 моль/л. Определить исходные концентрации иода и водорода.


