Основні поняття
Розділ 1. АТОМНО-МОЛЕКУЛЯРНА ТЕОРІЯ
Розглянуто основні поняття, такі як атом, молекула, моль, еквівалент тощо, а також стехіометричні закони, які є підґрунтям сучасної хімії. Основні поняття Усі речовини складаються з атомів хімічних елементів. Наприклад, складовими частинами води Н2О є елементи Гідроген і Оксиген. Хімічний елемент – вид атомів, що характеризується однаковим зарядом ядра. Атом – найменша частинка хімічного елемента, яка зберігає його властивості. Маси окремих атомів елементів періодичної системи знаходяться в межах величин 10-22 – 10-24г. Вірогідно, масу атома доцільніше виражати у вигляді відносної величини в атомних одиницях маси (а. о. м.). Атомна одиниця маси – дуже мала величина, що дорівнює 1/12 маси атома ізотопу Карбону 12С. В 12 г Карбону 12С міститься точно 6,02 × 1023 атомів, відповідно mа.о.м Відносна атомна маса елемента Ar – це відношення маси атома даного елемента (ma ) до маси 1 а. о. м.: Ar =
Відносна атомна маса виражається в а. о. м., відповідно маса атома – в грамах: ma = Ar m а.о.м.
Молекула – найменша частинка простої або складної речовини, яка здатна існувати самостійно і зберігати хімічні властивості цієї речовини. Проста речовина – одна з форм існування хімічного елемента, молекула якої складається з атомів одного елемента. Простих речовин у природі більше, ніж хімічних елементів, оскільки атоми одного і того ж елемента можуть утворювати кілька простих речовин. Це явище називається алотропією. Наприклад, елемент Оксиген утворює дві прості речовини – звичайний кисень О2 і озон О3. Складні речовини утворюються з атомів різних елементів. Наприклад, молекула калій нітрату KNO3 складається з атомів Калію, Нітроґену і Оксигену. Відносною молекулярною масою хімічної сполуки (Mr) є відношення маси однієї молекули даної сполуки mм до маси 1 а.о.м:
Mr =
Відносна молекулярна маса виражається в а.о.м., відповідно маса молекули – у грамах. Символ Mr, запропонований Міжнародною спілкою теоретичної та прикладної хімії (IUPAC – International Union of Pure and Applied Chemistry), cвідчить про відносний характер молекулярної маси (r – relative – відносний). У системі СІ за одиницю кількості речовини прийнято моль. Моль – це така кількість речовини, яка містить стільки молекул, атомів, іонів або інших структурних одиниць, скільки міститься атомів у 12 г ізотопу Карбону 12С. Число структурних одиниць, що міститься в одному молі будь-якої речовини, називається сталою Авогадро ( NА ) і дорівнює 6,02·1023 моль-1. Маса одного моля речовини називається молярною масою (М) і виражається в г/моль. Молярна маса чисельно дорівнює відносній атомній або молекулярній масі. Наприклад, молярна маса сульфатної кислоти дорівнює 98 г/моль, оскільки відносна молекулярна маса H2SO4 складає 98 а.о.м. Для проведення розрахунків часто необхідно знати масу декількох молей або, навпаки, знайти кількість речовини, яка міститься в даній її масі. Кількість речовини n(x) знаходять з відношення маси m(x) цієї речовини до її молярної маси М(x): n(x) = В одному молі сполуки вміщується певна кількість молей атомів елементів. Наприклад, в одному молі магній хлориду MgCl2 вміщується 1 моль атомів Магнію і 2 молі атомів Хлору. У 1794 р. німецьким вченим Ріхтером упроваджено поняття еквівалента. Еквівалентом елемента або хімічної сполуки називається така їх кількість, яка поєднується з 1 молем атомів Гідрогену або заміщує ту ж саму кількість атомів Гідрогену у хімічних реакціях. Одиницею кількості речовини є моль, тому еквіваленти також вимірюються у молях. Наприклад, у сполуках HCl, H2S, NH3 еквіваленти Хлору, Сульфуру, Нітроґену відповідно дорівнюють 1 молю атомів Хлору, 1/2 моля атомів Сульфуру, 1/3 моля атомів Нітроґену. Еквівалент елемента може бути визначений не тільки за Гідрогеном, але й за будь-яким іншим елементом, еквівалент якого відомий. Так, еквівалент Оксигену дорівнює 1/2 моля атома. Тоді у діоксиді сульфуру SO2, у молі якого вміщується 1 моль атомів Сульфуру й 2 моля атомів Оксигену, еквівалент Сульфуру дорівнюватиме 1/4 молю S, а у триоксиді SO3 – 1/6 молю S. Маса одного еквівалента елемента або сполуки, виражена в грамах, називається молярною масою еквівалента Ме. Так, в сполуках HCl, H2S, NH3 молярна маса еквівалента Хлору, Сульфуру, Нітроґену відповідно дорівнює 35,5; 32,2 і 14,3 г/моль. Молярну масу еквівалента елемента Ме легко розрахувати, якщо поділити його молярну масу на валентність (В): Ме =
Наприклад, молярні маси еквівалента фосфору в сполуках PCl3 і PCl5 будуть відповідно: Ме =
Ме=
Молярні маси еквівалентів складних речовин розраховують за наведеними нижче формулами: Ме оксиду =
Ме оксиду = Ме елемента + Ме кисню;
Ме кислоти =
Основність кислоти дорівнює числу іонів Гідрогену, що заміщуються на катіони металу в кислоті.
Ме основи =
Кислотність основи дорівнює числу гідроксильних груп, що заміщуються на кислотний залишок в основі. Ме солі =
В окисно-відновних реакціях молярна маса еквівалента речовини визначається кількістю електронів, приєднаних або відданих атомом елементу в цій речовині. Часто замість поняття “молярна маса еквівалента” користуються поняттям “молярний об’єм еквівалента”. Молярний об’єм еквівалента (Vе) – це об’єм, що займає один еквівалент даної газоподібної речовини за нормальних умов. Так, еквівалент Гідрогену дорівнює 1 молю, а 1 моль Н2 містить 2 молі атомів Гідрогену. Об’єм моля молекул водню за нормальних умов дорівнює 22,4 л. Тому молярний об’єм еквівалента Н2 Vе(Н2) = 1/2 × 22,4 = 11,2 л/моль. Аналогічно еквівалент атомів Оксигену дорівнює 1/2 моля атомів О, що відповідає 1/4 моля молекул О2, молярний об’єм еквівалента О2 Vе (О2) = 1/4 × 22,4 = 5,6 л/моль.
|

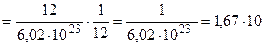 -24 г/а.о.м.
-24 г/а.о.м.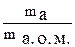 .
.
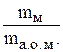 .
.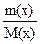 .
.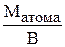 .
. 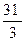 = 10,03 г/моль;
= 10,03 г/моль;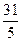 = 6,2 г/моль.
= 6,2 г/моль.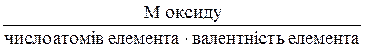 ;
;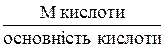 .
.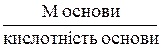 .
. .
.


