В рівних об’ємах різних газів за однакових умов (температури і тиску) міститься однакова кількість молекул.
Із цього законувитікають наслідки: 1. Однакова кількість молекул газоподібних речовин при однакових умовах займає однаковий об’єм. 2. Моль будь-якої газоподібної речовини при температурі 273 К і тиску 101,325 кПа (нормальні умови) займає об’єм 22,4 л. Цей об’єм називається молярним об’ємом і позначається Vм. 3. Стехіометричні коефіцієнти у реакціях між газами показують співвідношення між об’ємами реагуючих та отриманих газів. На основі закону Авогадро і висновків з нього можна проводити різні розрахунки. Наприклад, визначити об’єм, який займають 64 г кисню за нормальних умов М(О2) = 32 г/моль, n =
V = Vмn = 22,4 × 2 = 44,8 л.
При переході від нормальних умов до будь-яких інших або навпаки використовують рівняння стану газу, яке об’єднує газові закони Бойля - Маріотта і Ґей-Люссакаі називається об ’ єднаним газовим законом:
де V – об’єм газу при тиску P і температурі Т; V0 – об’єм газу за нормальних умов (Т0 = 273 К; Р0 = 101325 Па). Для розрахунку молярної маси газоподібних речовин можна скористатися рівнянням Клапейрона – Менделєєва PV = де Р – тиск газу Па; М – молярна маса газу, г/моль; R – універсальна газова стала, що дорівнює 8,314 Дж/моль ∙ K (система СІ); Т – абсолютна температура, К. Часто при визначенні молярної маси газу користуються позасистемними одиницями тиску та об’єму. При цьому необхідно використовувати відповідні значення універсальної газової сталої. Так, якщо об’єм газу виміряно у мілілітрах, тиск у мм рт. ст., то універсальна газова стала R = 62360
Якщо об’єм газу виміряно у літрах, а тиск в атмосферах, то R = 0,082
Закон еквівалентів ( Ріхтер, Дальтон, початок ХІХ ст. ) формулюють так: речовини взаємодіють між собою в масових кількостях, пропорційних їх молярним масам еквівалентів:
Якщо одна речовина газоподібна, то за нормальних умов доцільно користуватися рівнянням
Для того щоб розрахувати кількість еквівалентів (nе) у даній масі речовини, користуються відношенням
ne =
|

 ,
,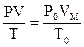 ,
,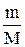 RT,
RT, V – об’єм газу, м3; m – маса газоподібної речовини, г;
V – об’єм газу, м3; m – маса газоподібної речовини, г; .
.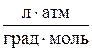 .
.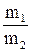 =
=  .
. =
=  .
.



