Приклади розв'язання типових задач
1. Визначити число молів атомів у 60 г вуглецю. Розв’язок. Молярнамаса вуглецю М(С) = 12 г/моль. n(С) =
2. Обчислити молярну масу еквівалента металу, знаючи, що його хлорид містить 65, 57% хлору. Молярна маса еквівалента хлору дорівнює 35,45 г/моль. Розв’язок. Позначимо: % Cl = m (Cl), % Ме = m (Ме). Згідно із законом еквівалентів
m(Me) = 100 – m(Cl) = 100 – 65,57 = 34,43.
3. При взаємодії 5,2 г металу з 3,5 г Нітроґену утворюється нітрид. Який це метал, якщо його валентність дорівнює 1, а валентність Нітроґену 3? Розв’язок. Згідно із законом еквівалентів
Ме(Ме) = Ме(Ме) = отже, М(Ме) = Ме(Ме) В; М(Ме) = 6,9∙1 = 6,9 г/моль. Невідомий метал – літій з молярною масою 6,9 г/моль. 4. Для розчинення 5,58 г Феруму знадобилось 7,3 г хлоридної кислоти. Яку формулу має утворювана сіль? Яка валентність Феруму і яку формулу має утворювана сіль? Розв’язок. Згідно із законом еквівалентів
отже, Ме(Fe) = де Ме(НС1) = 36,5 г/моль; Ме(Fe) = Ме(Fe) = звідси B(Fe) = Формула утвореної солі – FeC12. 5. Визначити число молів SO2, що містяться у 3 л газу (н. у.). Розв’язок. Число молів SO2 визначаємо за формулою
n(SO2) =
6. Визначити об’єм, що займають 5,4∙1022 молекул кисню (н. у.). Розв’язок. Об’єм О2 обчислимо згідно із законом еквівалентів
Питання для самоперевірки
1. Наведіть визначення таких понять, як хімічний елемент, атом, молекула, проста і складна речовина. Яка частинка первинна – атом чи молекула? 2. Що таке відносна атомна і молекулярна маси? 3. Дайте визначення еквівалента та молярної маси еквівалента. 4. Наведіть формули для розрахунків еквівалентів та їх молярних мас простих і складних речовин. 5. Сформулюйте закон еквівалентів. 6. Сформулюйте основні закони стехіометрії. 7. Чому закон Авогадро справедливий тільки для газів? Його наслідки. Засвоєння основних понять і законів хімії допоможе студентам у подальшому вивченні курсу хімії.
|

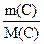 =
=  = 5 молів.
= 5 молів.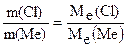 ;
;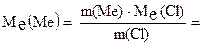
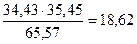 г/моль.
г/моль. ; Ме(N) = 4,67 г/моль;
; Ме(N) = 4,67 г/моль;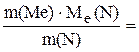
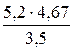 = 6,9 г/моль;
= 6,9 г/моль; ,
, ,
,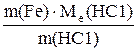 ,
,
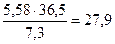 г/моль;
г/моль;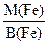 ,
,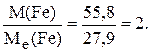
 моль.
моль.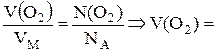

 = 2 л.
= 2 л.


