Примеры решений
Пример № 1. При некоторой температуре плотность паров серы по азоту равна 9,14. Определить молекулярную массу газообразной серы и число атомов серы в молекуле.
Решение. Определим молярную массу серы по уравнению: М(Sn) = М(N2).D(N2) = 28.9,14 = 256 (г/моль). Тогда число атомов серы
Ответ: 256 г/моль, S8. Пример № 2. Рассчитать фактор эквивалентности сульфата железа(III).
Решение. Используем формулу: fэ = где v - валентность катиона металла или кислотного остатка, n – число атомов в формульной единице соли (стехиометрический индекс в формуле). Для сульфата железа(III) - Fe2(SO4)3, v(Fe) = 3; n = 2, тогда fэ = 1/6.
Пример № 3. Рассчитать фактор эквивалентности цинка при взаимодействии металла с кислотой.
Решение. Один атом цинка вытесняет два атома водорода, отдавая при этом два электрона: Zn + 2H+ = Zn2+ + H2; Zn0 - 2e- = Zn2+ Следовательно, эквивалентом цинка является 1/2 его атома, т.е. 1/2 Zn (условная частица).
Пример № 4. Рассчитать фактор эквивалентности и эквивалентную массу серной кислоты в реакции ее полной нейтрализации.
Решение. Серная кислота отдает два катиона водорода: H2SO4 + 2KOH = K2SO4 + 2H2O Соответственно, фактор эквивалентности H2SO4 равен 1/2, а эквивалентная масса составляет: Э = М·fэ = 98×(1/2) = 49 (г/моль).
Пример № 5. Рассчитать факторы эквивалентности фосфорной кислоты в реакциях нейтрализации. Решение. Одно и то же соединение может иметь разный фактор эквивалентности в разных реакциях:
H3PO4 + KOH = KH2PO4 + H2O; fэ(H3PO4) = 1. H3PO4 + 2KOH = K2HPO4 + 2H2O; fэ(H3PO4) = 1/2. H3PO4 + 3KOH = K3PO4 + 3H2O; fэ(H3PO4) = 1/3.
Пример № 6. 1,60 г кальция и 2,61 г цинка вытесняют из воды одинаковые объемы водорода при одинаковых условиях. Вычислить эквивалент цинка, если эквивалентная масса кальция равна 20,0 г/моль.
Решение. Для решения задачи воспользуемся законом эквивалентов:
откуда
Ответ: 32,6 г/моль. Пример № 7. Вещество, плотность по водороду которого равна 21, состоит из углерода (85,71%) и водорода (14,29%). Определите его молекулярную формулу.
Решение. I способ. Примем массу исходного вещества за 100 г, тогда массы входящих в его состав элементов составят: углерод – 85,71 г; водород – 14,29 г. Определим количество элементов: n(Э) = n(C) = Представим искомую формулу как CxHy, тогда: х: у = n(С): n(H) =7,14: 14,29; х: у = 1: 2. Таким образом, простейшая формула соединения – СН2. Вычислим молекулярную массу соединения и установим истинную формулу: Mr(CxHy) = Следовательно молекулярная формула вещества – С3Н6.
II способ. Определим молярную массу вещества и массы элементов в одном моле: M(CxHy) = M(xC) = M(CxHy)·w(C) = 42·0,8571 = 36 (г/моль); M(yН) = M(CxHy)·w(Н) = 42·0,1429 = 6 (г/моль). Рассчитаем число атомов углерода и водорода в молекуле: x = Тогда формула имеет следующий вид - С3Н6.
Пример № 8. Вычислите формулу соединения, состоящего из углерода, водорода и серы, если при сжигании некоторой навески этого соединения было получено 896 мл оксида углерода(IV) (н.у.), 1,08 г воды и 1,28 г оксида серы(IV). Решение. Вычислим количества продуктов горения: n(СО2) = n(SO2) = Определим количества элементов, входящих в состав соединения: n(С) = n(СО2) = 0,04 моль; n(Н) = 2n(Н2О) = 0,12 моль; n(S) = n(SО2) = 0,02 моль. Представим формулу вещества как CxHySz, тогда: х: у: z = n(C): n(H): n(S) = 0,04: 0,12: 0,02. Разделив все числа на наименьшее (0,02), получим х: у: z = 2: 6: 1. Таким образом искомая формула – C2H6S.
|

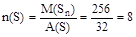 .
. ,
, ,
,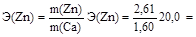 32,6 (г/моль).
32,6 (г/моль). ;
;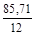 = 7,14 (моль); n(Н) =
= 7,14 (моль); n(Н) =  = 14,29 (моль).
= 14,29 (моль).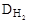 ·Mr(H2) = 21·2 = 42;
·Mr(H2) = 21·2 = 42; 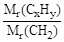 =
= 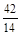 = 3.
= 3. ×M(H2) = 21·2 = 42 (г/моль);
×M(H2) = 21·2 = 42 (г/моль);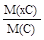 =
=  = 3; y =
= 3; y =  =
= 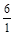 = 6.
= 6. =
= 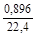 = 0,04 (моль); n(Н2О) =
= 0,04 (моль); n(Н2О) = 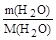 =
= 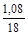 = 0,06 (моль);
= 0,06 (моль);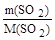 =
= 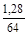 = 0,02 (моль).
= 0,02 (моль).


