Распределение энергии по степеням свободы.
В общем случае внутренняя энергия представляет собой сумму всех видов энергии, которыми обладают частицы тела. В идеальном газе молекулярное взаимодействие отсутствует, и поэтому его внутренняя энергия равна суммарной кинетической энергии молекул. Полученное нами выражение для средней кинетической энергии молекулы
- две степени свободы поступательного движения;
- три степени свободы вращательного движения. Соответственно, положение шара на столе можно задать пятью координатами - x, y и α, β, γ. Таким образом, число степеней свободы любого тела или системы тел равно количеству независимых величин (координат), с помощью которых может быть задано положение системы. Хаотичность молекулярного движения требует, чтобы на любую из трех степеней свободы приходилось одно и то же количество кинетической энергии, т.е.
Исходя из молекулярной теории газов, Максвелл и Больцман пришли к принципу равномерного распределения кинетической энергии молекул по всем степеням свободы. Это значит, что на одну степень свободы поступательного, вращательного или колебательного движения приходится одна и та же величина энергии
I = mr2 ≈ 0.
Для двухатомных молекул одну из осей вращения всегда можно совместить с осью молекулы (см. рис.). Вращение вокруг этой оси равносильно вращению отдельных атомов, т.е. его энергия равна нулю. Поэтому двухатомной молекуле с жесткой связью между атомами следует приписать пять степеней свободы: три поступательного и две вращательного. Для молекул с числом атомов три и более, которые связаны между собой жестко, число степеней свободы равно шести. Если связь между атомами в молекуле имеет упругий характер, то появляются колебательные степени свободы. Однако учет энергии, связанной с колебательными степенями свободы, как оказалось, довольно сложен, т.к. энергия, которая приходится на одну степень свободы колебательного движения зависит от температуры и частоты колебаний атомов
Опыт показывает, что при небольших температурах энергией колебательного движения можно пренебречь. И мы ее в дальнейшем учитывать не будем. Если обозначить теперь число степеней свободы через j, то кинетическая энергия одной молекулы
Для произвольной массы газа ∆m:
Эксперимент при низких температурах подтверждает выводы.
|

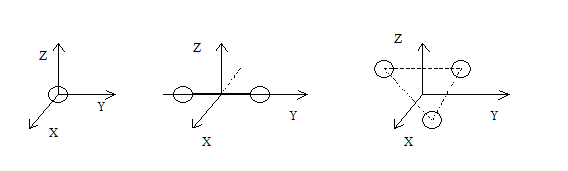
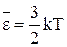 учитывает только энергию поступательного движения. Однако наряду с поступательным движением возможно также вращение молекул и колебания атомов, входящих в их состав. Понятно, эти виды движения тоже связаны с некоторым запасом энергии. Возникает вопрос, какая доля энергии приходится на тот или другой вид движения. Чтобы ответить на него, введем понятие степени свободы. Под степенями свободы понимают те независимые от других движения, которые может совершать данное тело. Например, любое тело обладает тремя степенями свободы поступательного движения: вправо-влево, вперед-назад, вверх-вниз. Соответственно, это приводит к изменению трех координат - X,Y,Z, которые определяют его положение в пространстве. Кроме того, тело может совершать три независимых вращательных движения вокруг трех пространственных осей. Изменение положения тела из-за вращения определяется углами поворота - α, β, γ. Биллиардный шар на столе:
учитывает только энергию поступательного движения. Однако наряду с поступательным движением возможно также вращение молекул и колебания атомов, входящих в их состав. Понятно, эти виды движения тоже связаны с некоторым запасом энергии. Возникает вопрос, какая доля энергии приходится на тот или другой вид движения. Чтобы ответить на него, введем понятие степени свободы. Под степенями свободы понимают те независимые от других движения, которые может совершать данное тело. Например, любое тело обладает тремя степенями свободы поступательного движения: вправо-влево, вперед-назад, вверх-вниз. Соответственно, это приводит к изменению трех координат - X,Y,Z, которые определяют его положение в пространстве. Кроме того, тело может совершать три независимых вращательных движения вокруг трех пространственных осей. Изменение положения тела из-за вращения определяется углами поворота - α, β, γ. Биллиардный шар на столе:
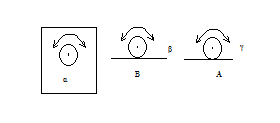
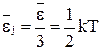 (16).
(16).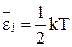 .
.
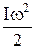 таких молекул бесконечно мала, т.к. r → 0,
таких молекул бесконечно мала, т.к. r → 0,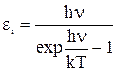 (18).
(18). , а внутренняя энергия одного моля идеального газа:
, а внутренняя энергия одного моля идеального газа: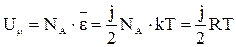 (19).
(19).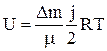 (20).
(20).


