Общие сведения о массообменных процессах
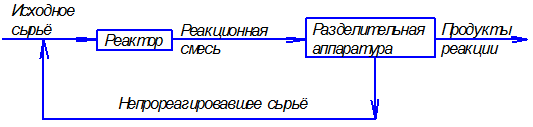
Технологические процессы, скорость протекания которых определяется скоростью переноса вещества из одной фазы в другую, называются массообменными, а аппараты, в которых происходят эти процессы, – массообменными аппаратами. Массообменные процессы занимают особое место среди химико-технологических процессов. В большинстве производственных установок химической промышленности массообменный и реакционный аппараты связаны по следующей схеме (рис. 1.1).
Рис. 1.1. Схема технологического процесса с массообменным аппаратом
Исходное сырье поступает в реактор, где частично превращается в продукты реакции, поскольку химические реакции с получением целевых продуктов не протекают до конца. Выходящая из реактора смесь продуктов реакции и сырья, не участвующего в реакции, направляется в массообменную разделительную аппаратуру. В аппаратуре производится разделение смеси на продукты реакции и непрореагировавшее сырье, которое возвращается в реактор, а продукты реакции поступают на дальнейшую переработку. Отсюда следует, что между реакционными и разделительными аппаратами существует тесная технологическая связь. Закон этой связи таков: чем меньше нагрузка на реакционный аппарат, т.е. чем меньше превращение исходного сырья в продукты реакции, тем больше нагрузка на разделительный аппарат, и наоборот. Оптимальное сочетание нагрузок на реакционный и разделительный аппараты обеспечивает минимальные производственные затраты. Поэтому основа химического производства – реактор – работает оптимально только в сочетании с оптимально работающим разделительным аппаратом. В этой связи работа массоообменного аппарата в химической промышленности имеет не меньшее значение, чем работа самого реактора. В разделительном аппарате могут производиться разнообразные процессы. Основными и важнейшими из них являются абсорбция, ректификация, экстракция, кристаллизация, адсорбция, сушка, ионнообменные процессы и мембранное разделение. Абсорбцией называется процесс разделения, основанный на избирательном поглощении газов или паров жидкими поглотителями – адсорбентами. Этот процесс применяется во многих производствах, в которых из смеси газов необходимо извлечь какое-либо вещество или комплекс веществ. В процессе абсорбции имеет место переход вещества или группы веществ из газовой (паровой) фазы в жидкую. Обратный процесс называется десорбцией. Ректификацией называется процесс разделения смеси жидкостей, имеющих различные температуры кипения при соответствующем давлении, на чистые или обогащенные составляющие в результате противоточного движения потоков пара и жидкости. Процесс имеет большое значение в тех производствах, в которых необходимо частичное или полное разделение жидких однородных смесей на чистые компоненты или их группы. В процессе ректификации имеет место переход вещества или группы веществ из жидкой фазы в паровую, и наоборот. Экстракцией называется процесс разделения, основанный на извлечении растворенного в одной жидкости вещества или группы веществ другой жидкостью, которая не смешивается или только частично смешивается с первой. Процесс применяется в тех случаях, когда из раствора необходимо извлечь растворенное вещество или группу веществ. В этом процессе имеет место переход вещества из одной жидкой фазы в другую жидкую фазу. Адсорбцией называется процесс разделения, основанный на избирательном поглощении газов, паров или растворенных в жидкостях веществ, твердым пористым поглотителем – адсорбентом, способным поглощать одно или несколько веществ из их смеси. Процесс используется в тех производствах, где из смеси газов, паров или растворенных веществ необходимо извлечение того или иного вещества. В этом процессе вещества переходят из газовой или жидкой фаз в твердую. Обратный процесс называется десорбцией. Ионнообменный процесс представляет собой процесс извлечения вещества из раствора, основанный на способности некоторых твердых веществ (ионитов) обменивать свои подвижные ионы на ионы извлекаемого вещества. Процесс применяется для извлечения веществ из растворов, имеющих низкую концентрацию.В этом процессе вещества переходят из жидкой фазы в твердую. Сушкой называется процесс удаления влаги из твердых влажных материалов путем ее испарения. Процесс необходим для тех производств, в которых влажные природные вещества предварительно до их переработки или готовые вещества в последней стадии производства должны быть обезвожены. В этом процессе имеет место переход влаги из твердого влажного материала в паровую или газовую фазу. Кристаллизацией называется процесс разделения, основанный на выделении вещества в виде твердой фазы (кристаллов) из жидкой фазы. Процесс имеет место в тех случаях, где требуется получение веществ повышенной чистоты. В этом процессе происходит переход вещества из жидкой фазы в твердую фазу. Обратный процесс – растворение. Мембранное разделение основано на способности определенных тонких пленок (полупроницаемых мембран) пропускать одни вещества и задерживать другие. В этом процессе вещества переходят через полупроницаемую мембрану из исходной жидкости или газа в жидкую или газовую фазу, находящуюся за мембраной. Из краткой характеристики следует, что для всех массообменных процессов характерным является переход вещества из одной фазы в другую, или массопередача. Процессы массопередачи делятся на две группы. К одной группе процессов относятся, например, перегонка, кристаллизация, в которых минимально два вещества, составляющие две фазы, обмениваются компонентами и сами непосредственно участвуют в массопередаче. В другой группе процессов в большинстве случаев в массопередаче участвуют три вещества: распределяющее вещество (или вещества), составляющее первую фазу; распределяющее вещество (или вещества), составляющее вторую фазу; распределяемое вещество (или вещества), которое переходит из одной фазы в другую. К этой группе относятся процессы: абсорбции, экстракции, адсорбции, сушки. Одну фазу обозначим буквой G, другую L, а распределяемый компонент М. Поскольку все массообменные процессы обратимы, то распределяемое вещество может переходить в зависимости от концентрации этого вещества в распределяющих фазах из фазы G в фазу L и наоборот. Представим для первой группы процессов массопередачи, что распределяемое вещество находится вначале только в фазе G и имеет концентрацию Если распределяющие фазы привести в соприкосновение, начнется переход распределяемого вещества из фазы G в фазу L, и в жидкой фазе появится распределяемый компонент с концентрацией, отличной от нуля. С момента появления вещества М в фазе L начинается обратный переход его в фазу G. До некоторого момента времени число частиц М, переходящих в единицу времени через единицу поверхности фазового контакта из фазы G в фазу L, больше, чем число частиц, переходящих обратно из фазы L в фазу G. Через определенный промежуток времени скорости перехода распределяемого вещества из фазы G в фазу L и обратно становятся одинаковыми. Такое состояние называется равновесным. В состоянии равновесия существует строго определенная зависимость между концентрациями распределяемого вещества в фазах, которые при равновесии системы называются равновесными. Любой концентрации
Условия равновесия и равновесные зависимости могут быть выражены не только через концентрации, но и через другие параметры, например, энтальпии, химический потенциал. Знание равновесных концентраций позволяет установить направление течения процесса, которое определяется стремлением к равновесию. Если Основными задачами, изучаемыми в массопередаче, являются: законы фазового равновесия, позволяющие определить равновесные концентрации и направление течения процесса; движущая сила массообменных процессов; коэффициенты скорости массообменных процессов. Последние две задачи составляют так называемую кинетику процесса массопередачи; вопросы фазового равновесия (первая задача) – статику процесса. Эти задачи рассматриваются раздельно при изучении каждого конкретного процесса. Способы выражения концентраций. Движущая сила массообменных процессов выражается в большинстве случаев концентрациями распределяемого вещества в распределяющих фазах. В расчетной практике пользуются различными способами выражения концентраций, а именно: Вполне очевидно, что в зависимости от способа выражения концентраций численное значение движущей силы меняется. Между концентрациями существует связь, которая может быть получена в виде простых математических соотношений из физического смысла концентраций. Например, если рассматривать смесь, состоящую из двух компонентов А и В, то связь массовых долей с мольными, и наоборот, определяется по следующим зависимостям:
Соответственно связь относительных массовых и массовых долей
объемных концентраций и массовых долей
|

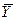 . В фазе L в начальный момент распределяемого вещества нет и, следовательно, концентрация его в этой фазе
. В фазе L в начальный момент распределяемого вещества нет и, следовательно, концентрация его в этой фазе 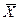 =0.
=0.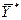 , и наоборот, любой концентрации
, и наоборот, любой концентрации  , т. е. имеют место зависимости вида
, т. е. имеют место зависимости вида или
или 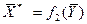 .
.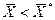 , распределяемое вещество М будет переходить из фазы G в фазу L. При условии
, распределяемое вещество М будет переходить из фазы G в фазу L. При условии 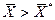 ) распределяемое вещество будет переходить из фазы L в фазу G.
) распределяемое вещество будет переходить из фазы L в фазу G. – в кмоль распределяемого компонента/кмоль смеси – мольная доля;
– в кмоль распределяемого компонента/кмоль смеси – мольная доля; 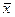 – в кг распределяемого компонента /кг смеси – массовая доля;
– в кг распределяемого компонента /кг смеси – массовая доля;  в кмоль распределяемого компонента/кмоль инертного вещества фазы – относительная мольная доля;
в кмоль распределяемого компонента/кмоль инертного вещества фазы – относительная мольная доля; 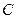 в кмоль распределяемого компонента /м3 фазы – мольная объемная концентрация;
в кмоль распределяемого компонента /м3 фазы – мольная объемная концентрация;  в кг распределяемого компонента/м3 фазы – массовая объемная концентрация.
в кг распределяемого компонента/м3 фазы – массовая объемная концентрация.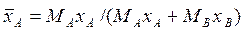 ;
; 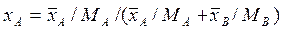 .
. ,
,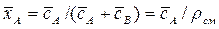 .
.


