Равновесие в процессах адсорбции
Природа сил, вызывающих адсорбцию, может быть различной. При адсорбции происходит концентрация молекул поглощаемого вещества на поверхности адсорбента под действием Ван-дер-Ваальсовых сил. Этот процесс часто сопровождается конденсацией паров поглощаемого вещества в капиллярных порах адсорбента, присоединением молекул поглощаемого вещества по месту ненасыщенных валентностей элементов, составляющих кристаллическую решетку адсорбента, и другими процессами. Независимо от природы адсорбционных сил на величину адсорбции влияют следующие факторы: природа поглощаемого вещества, температура, давление и примеси в фазе, из которой поглощается вещество. Согласно основным положениям массопередачи, равновесные соотношения при адсорбции должны выражать зависимости между концентрацией адсорбированного твердым телом вещества – адсорбатом и равновесной концентрацией поглощаемого вещества из парогазовой смеси или раствора – адсорбтивом. Если поглощаемым веществом является газ или пар, то равновесную концентрацию в парогазовой смеси можно заменить парциальным давлением. Наиболее просто равновесные соотношения при адсорбции выражаются уравнением Ленгмюра:
или уравнением Фрейндлиха:
Последнее уравнение может быть преобразовано к виду
где p – парциальное давление поглощенного вещества в парогазовой смеси; Концентрацию Природа поглощаемого вещества существенно влияет на равновесие при адсорбции. Кривые типа
Рис. 5.1. Изотермы адсорбции различных газов активированным углем
Температура и давление также относятся к весьма существенным факторам, влияющим на равновесие. На рис. 5.2. приведена равновесная зависимость
Рис. 5.2. Изотермы адсорбции оксида углерода активированным углем Примеси в фазе, из которой поглощается вещество. Установлено, что при адсорбции двух или нескольких веществ обнаружено, что адсорбируются все компоненты смеси, причем степень адсорбции каждого компонента ниже, чем адсорбция индивидуального вещества в тех же условиях, а соотношения их концентраций в адсорбенте будут обратно пропорциональны их относительной летучести. Адсорбенты характеризуются статической и динамической активностью. После некоторого периода работы адсорбент перестает полностью поглощать извлекаемый компонент и наблюдается «проскок» компонента через слой адсорбента. С этого момента концентрация компонента в отходящей парогазовой смеси возрастает вплоть до наступления равновесия. Количество вещества, поглощенного единицей массы адсорбента за время от начала адсорбции до начала «проскока», определяет динамическую активность адсорбента. Количество вещества, поглощенного тем же количеством адсорбента за время от начала адсорбции до установления равновесия, характеризует статическую активность. Статическая и динамическая активности адсорбента зависят от температуры газа и концентрации в нем поглощенного компонента. Динамическая активность всегда меньше статической, поэтому расход адсорбента определяется по его динамической активности. В процессе адсорбции может выделяться значительное количество тепла. Теплоту адсорбции обычно определяют опытным путем. Ее также можно вычислить по уравнению
где
|

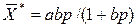
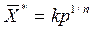 .
.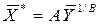 ,
,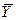 – равновесная концентрация в парогазовой смеси или растворе; а, b, k, А, n,
– равновесная концентрация в парогазовой смеси или растворе; а, b, k, А, n, иногда называют адсорбционной емкостью, или активностью адсорбента. На равновесные соотношения при адсорбции оказывают влияние следующие факторы.
иногда называют адсорбционной емкостью, или активностью адсорбента. На равновесные соотношения при адсорбции оказывают влияние следующие факторы. или
или 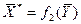 при постоянной температуре называют изотермами адсорбции. Для азота, диоксида углерода и паров бензола изотермы адсорбции приведены на рис. 5.1. Считается правилом, что равновесная концентрация
при постоянной температуре называют изотермами адсорбции. Для азота, диоксида углерода и паров бензола изотермы адсорбции приведены на рис. 5.1. Считается правилом, что равновесная концентрация 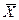 тем выше, чем больше молекулярная масса поглощаемого газа, а в случае раствора – чем меньше растворимость поглощаемого вещества в жидкости.
тем выше, чем больше молекулярная масса поглощаемого газа, а в случае раствора – чем меньше растворимость поглощаемого вещества в жидкости.
 для системы оксид углерода-активированный уголь при различных температурах. С повышением температуры равновесная концентрация уменьшается, с повышением давления – увеличивается. Из рисунков 5.1 и 5.2. следует также, что с ростом давления в паро-газовой фазе равновесная концентрация
для системы оксид углерода-активированный уголь при различных температурах. С повышением температуры равновесная концентрация уменьшается, с повышением давления – увеличивается. Из рисунков 5.1 и 5.2. следует также, что с ростом давления в паро-газовой фазе равновесная концентрация 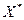 увеличивается.
увеличивается.
 19,16
19,16  ,
, и
и 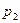 – равновесные давления поглощаемого вещества над адсорбентом при соответствующих температурах.
– равновесные давления поглощаемого вещества над адсорбентом при соответствующих температурах.


