Йонно-електронний метод
Для складання рівнянь окисно-відновних реакцій застосовують також йонно-електронний метод. 1. Рівняння реакції записують йонно-електронними напівреакціями:
6 (23)
Перше рівняння відновлення біхромат іона показує, що під час перетворення йона Друге рівняння процесу окиснення Сірки показує, що цей процес відбувається без участі йонів Гідрогену. 2. Знайшовши спільний множник (6) для цих двох йонно-електронних рівнянь і помноживши кожне з них на відповідні коефіцієнти (1 та 3), дістають сумарне йонне рівняння даної окисно-відновної реакції. Вірність сумарного рівняння перевіряють за тими ж ознаками, що і в методі електронного балансу, тільки напослідок перевіряють не суму ступенів окиснення, а суму зарядів йонів у обох частинах: (2−) + (14+) + 3(2−) = 2(3+) + 3(0) → (6+) = (6+). 3. Знайдені коефіцієнти переносять у вихідне молекулярне рівняння, а потім згідно з методом електронного балансу визначають число молекул H2SO4 (4) та H2O (7):
K2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + 3S + K2SO4 + 7H2O. (24)
Контрольні питання та завдання
1. На чому базується метод електронного балансу? 2. Назвіть послідовність дій під час визначення коефіцієнтів у рівняннях окисно-відновних реакцій методом електронного балансу. 3. У чому особливість деяких міжмолекулярних реакцій, у яких окисник або відновник одночасно є і середовищем?
3. ОКИСНИКИ І ВІДНОВНИКИ
Окисно-відновну здатність елементів якісно можна оцінювати за їх положенням у періодичній системі Д.І. Менделєєва, величинами енергії іонізації та електронегативності. Необхідно знати, що згідно з окисно-відновною функцією елементи розподіляють на три групи: – тільки відновники; – тільки окисники; – окисники або відновники залежно від умов.
3.1. Відновники
Тільки відновниками можуть бути: – вільні атоми металів усіх сімейств: s, р, d, f; – хімічні сполуки, що містять неметалеві елементи головних підгруп
|


 6 1 – відновлення, окисник
6 1 – відновлення, окисник  ;
;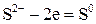 2 3 – окиснення, відновник
2 3 – окиснення, відновник  ;
;
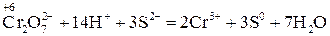 .
.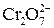 на катіон
на катіон  сім атомів Оксигену повинні зв'язуватися з 14 йонами Гідрогену (кисле середовище), утворюючи 7 молекул води.
сім атомів Оксигену повинні зв'язуватися з 14 йонами Гідрогену (кисле середовище), утворюючи 7 молекул води. ,
,  ,
, 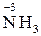 ,
,  та ін.
та ін.


