Метод електронного балансу
ВСТУП
Мета методичних вказівок – допомогти студентам у самостійній роботі над вивченням теми про окисно-відновні процеси та реакції. Окисно-відновні реакції – одне з найважливіших теоретичних питань основних розділів загальної, неорганічної, органічної, аналітичної та фізичної хімії. Окисно-відновні реакції надзвичайно поширені у природі: процеси фотосинтезу, дихання, травлення, підтримування життєдіяльності біологічних систем. Ці реакції відіграють важливу роль у практичній діяльності людини (вилучення металів і неметалів з руд, використання хімічних джерел струму, синтез хімічних продуктів, боротьба з корозією металів і т.п.). Методичні вказівки дають можливість студентам засвоїти такі поняття, як ступінь окиснення елементів, окисник, відновник, процеси окиснення, відновлення та набудуть практичних навичок методами електронного та іонно-електронного балансів, визначати коефіцієнти в рівняннях окисно-відновних реакцій.
1. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
1.1. Ступінь окиснення елементів
У багатьох хімічних реакціях утворення речовин відбувається в результаті переміщення електронів від одних частинок до інших. Залежно від ступеня зміщення електронів виникають сполуки різного характеру: від іонного до ковалентно-неполярного. Для характеристики стану електронів у хімічних сполуках впроваджено поняття ступеня окиснення. Ступенем окиснення елемента називається формальний заряд, який визначається числом електронів, зміщених від атома або до атома даного елемента у сполуці. Позитивний ступінь окиснення означає число електронів, що зміщується від даного атома, а негативний – до даного атома. З цього витікає, що у сполуках з неполярним зв'язком ступінь окиснення елементів дорівнює нулю. У простих іонних сполуках ступінь окиснення елементів відповідає електричному заряду (заряду іона), оскільки при утворенні цих сполук відбувається практично повний перехід електронів від одного атома до іншого. У сполуках з полярними ковалентними зв'язками ступінь окиснення визначається величиною електронегативності. Елементи з більшою електронегативністю мають негативний ступінь окиснення, а з меншою – позитивний. Необхідно запам'ятати випадки, коли елементи мають постійний ступінь окиснення. Ступінь окиснення елемента у простій сполуці і в елементарному стані дорівнює нулю: У молекулах складних речовин ступінь окиснення Гідрогену (окрім гідридів металів) дорівнює +1, а Оксигену −2: У сполуках з металами і Гідрогеном ступінь окиснення галогенів F, Сl, Вr, І дорівнює −1, Сульфуру –2: У сполуках з Оксигеном максимальний позитивний ступінь окиснення Сульфуру, Фосфору, Нітроґену, Хлору дорівнює номеру групи: Ступінь окиснення металів у сполуках з Сульфуром, галогенамитаіншими неметалами відповідає заряду іона металу:
Слід мати на увазі, що, позначаючи ступінь окиснення, спочатку ставлять знак, а після нього – число. Заряд іона записують зворотним порядком: спочатку ставлять число, а потім – знак. При цьому ступінь окиснення пишуть над символом елемента, а заряд іона – праворуч від нього. Більшість елементів може виявляти різний ступінь окиснення у сполуках. При його визначенні користуються правилом, згідно з яким сума ступенів
1.2. Поняття про окисно-відновні реакції Усі хімічні реакції можна розподілити на дві групи. У реакціях першої групи ступінь окиснення всіх елементів, що входять до складу речовин, залишається незмінним, а у реакціях другої групи – змінюється. Як приклад реакцій першої групи можна навести реакцію розчинів
Прикладом реакцій другої групи може служити взаємодія цинку з купрум (ІІ) сульфуром:
Якщо в реакції (І) жоден елемент не змінює ступеня окиснення, то у Реакції, у результаті яких змінюються ступені окиснення елементів, називаються окисно-відновними. Слід звернути увагу на те, що окисно-відновні процеси надзвичайно поширені у природі (засвоєння вуглекислого газу рослинами, корозія металів та ін.) і відіграють важливу роль у практичній діяльності людини (вилучення металів і неметалів з руд, використання хімічних джерел струму, боротьба з корозією, виробництво хімічних продуктів і т.п.). З електронної точки зору окисно-відновний процес пов'язаний з переміщенням електронів від одних частинок (атомів, молекул, іонів) до інших. Так, у наведеній реакції (2) електрони від атомів Цинку переходять до іонів Купруму:
(3)
Процес втрати частинок електронів називається окисненням, а процес приєднання електронів до частинки – відновленням. Отже, у розглянутій Речовина, до складу якої входить елемент, що окиснюється (тобто елемент, який втрачає електрони), називається відновником, а речовина, яка містить елемент, що відновлюється (тобто елемент, який приєднує електрони) – окисником. У наведеному прикладі CuSO4 – окисник, а Zn – відновник. З рівняння (3) видно, що атом цинку втрачає, а іон купруму приєднує два електрони. Таким чином, при окисно-відновних реакціях загальне число електронів, що віддає відновник, повинно дорівнювати загальному числу електронів, що приєднує окисник. На цій підставі засновано існуючі методи визначення коефіцієнтів у окисно-відновних реакціях: електронного балансу та іонно-електронний.
Контрольні питання та завдання
1. Чим визначається позитивний та негативний ступені окислення елементів? 2. Чому дорівнює сума ступенів окиснення елементів у молекулах сполук? 3. Визначте ступені окиснення елементів у молекулах таких сполук: HNO3, BaCL2, Cr2(SO4)3, (AlOH)3(PO4)2. 4. Які реакції називаються окисно-відновними? 5. Які процеси відбуваються під час окиснення та відновлення частинок?
2. СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ Метод електронного балансу
Для запису рівняння окисно-відновної реакції треба знати властивості Запис вихідних речовин і продуктів реакції виглядає так:
У тому разі, коли відомі вихідні і кінцеві продукти реакції, визначення коефіцієнтів у рівнянні цієї реакції відбувається задопомогою методу електронного балансу. Для його успішного засвоєння необхідно знати таку послідовність дій: 1. Визначають ступінь окиснення елементів у речовинах лівої і правої частин рівняння:
Позначають елементи, ступінь окиснення яких у ході реакції змінився. У нашому випадку такими елементами є Хром і Сульфур. 2. Складають рівняння електронного балансу з урахуванням загального числа атомів, які окиснилися і відновилися. У К2Сr2О7 (окисник) два атоми Хрому приєднують 6 електронів (відновлення), а у Н2S (відновник) атом Сульфуру втрачає 2 електрони (окиснення):
6 (6)
Виходячи з того, що число електронів, яке віддає відновник, повинно дорівнювати числу електронів, отриманих окисником, за правилом найменшого загального кратного визначають у рівнянні реакції основні коефіцієнти для відновника (3) і окисника (1), які у подальшому в багатьох випадках залишаються незмінними. Помноживши перше рівняння на коефіцієнт (1), а друге – на (3), знаходять загальне рівняння (7) як суму перших двох. Вірність цього рівняння перевіряють за рівністю обох його частин: – кількості відданих та приєднаних електронів (6 – кількості однойменних атомів (2Cr, 3S); – сум ступенів окиснення: + 12 – 6 = + 6 + 0 → + 6 = + 6. 3. Переносять знайдені коефіцієнти перед Cr та S у вихідне рівняння з урахуванням числа атомів, що входять до складу відповідних молекул речовин:
4. Далі перевіряють число атомів металів, що не змінюють ступінь окиснення (Калію), кислотних залишків (груп 5. За числом атомів гідрогену у вихідних речовинах (14) знаходять число молекул води, що утворилися (7), і записують рівняння реакції в остаточному вигляді:
6. Правильність визначення коефіцієнтів у рівнянні реакції перевіряють по числу атомів Оксигену в обох його частинах (23). Наведена вище методика складання рівнянь може бути застосована до
2.2. Окремі випадки складання рівнянь окисно-відновних реакцій
Розглянутий вище приклад належить до типу міжмолекулярних реакцій, у яких окисник, відновник і середовище являють собою різні речовини. Серед подібного типу зустрічаються такі, у яких окисник або відновник одночасно є і середовищем. Наприклад, реакція взаємодії калій перманґанату з концентрованою хлоридною кислотою:
Оскільки НСІ є одночасно і відновником, і середовищем, у якому протікає процес, то у рівнянні реакції доцільно формулу хлоридної кислоти записати двічі:
  + 5 + 5 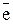 = = 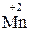 2 – відновлення, окисник KMnO4; 2 – відновлення, окисник KMnO4;
За числом атомів Калію у КМnО4 знаходять число молекул КСІ (2), а за числом атомів Хлору (6) у правій частині, що не змінили ступеня окиснення, – коефіцієнт перед НСІ-середовищем (6):
Визначають число молекул води (8) і остаточно записують рівняння:
До внутрішньомолекулярних реакцій належать такі, у яких змінюються ступені окиснення атомів у одній і тій самій молекулі. Наприклад, це реакції термічного розкладу:
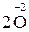 – 4 – 4 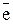 = = 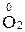 4 3 – окиснення, відновник KClO3; 4 3 – окиснення, відновник KClO3;
У реакціях диспропорціювання (самоокиснення – самовідновлення ) відбувається збільшення і зменшення ступеня окиснення одного й того елемента:
 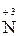 – 2 – 2 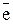 = = 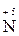 2 1 – окиснення, відновник HNO2; 2 1 – окиснення, відновник HNO2;
2.3. Складні окисно-відновні реакції Трапляються особливі випадки добору коефіцієнтів в рівняннях окисно-відновних реакцій, в яких ступень окиснення змінюють не два, як в багатьох випадках, а три елементи. У цьому разі дотримуються такої послідовності дій: 1. Визначають ступені окиснення елементів, що входять до складу сполук у обох частинах рівняння окисно-відновної реакції, та виділяють елементи, ступені окиснення яких змінюються:
2. Складають рівняння напівреакцій окиснення і відновлення:
2 3
3. Підсумовують перше та друге рівняння окиснення
2
4. Об'єднують рівняння (18) з рівнянням відновлення
84 (19)
5. Переносять знайдені коефіцієнти у вихідне молекулярне рівняння з урахуванням числа атомів в молекулах речовин:
6. За кількістю атомів Гідрогену, яке дорівнює 36 у правій частині рівняння, знаходять, що число молекул води у лівій частині дорівнює 4:
7. Правильність визначення коефіцієнтів перевіряють за рівністю атомів Оксигену, що дорівнює 88 у обох частинах рівняння окисно-відновної реакції.
|


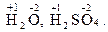 Ступінь окиснення елементів головних підгруп І, II і III груп періодичної системи у сполуках завжди позитивний і дорівнює номеру групи:
Ступінь окиснення елементів головних підгруп І, II і III груп періодичної системи у сполуках завжди позитивний і дорівнює номеру групи: 
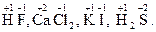

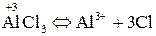 ¯.
¯.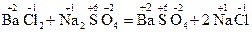 . (1)
. (1)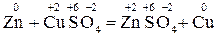 . (2)
. (2)
 – 2
– 2 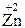 – окиснення, відновник Zn;
– окиснення, відновник Zn;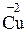 + 2
+ 2  – відновлення, окисник CuSO4;
– відновлення, окисник CuSO4;
 =
=  .
. . (4)
. (4) (5)
(5)
 + 6
+ 6 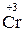 6 1 – відновлення, окисник K2 Cr2 O7;
6 1 – відновлення, окисник K2 Cr2 O7;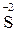 – 2
– 2  2 3 – окиснення, відновник H2S.
2 3 – окиснення, відновник H2S.

 (8)
(8) ) і встановлюють коефіцієнти для K2SO4 (1) і H2SO4 (4).
) і встановлюють коефіцієнти для K2SO4 (1) і H2SO4 (4).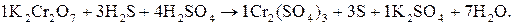 (9)
(9) (10)
(10) (11)
(11) – 2
– 2  5 – окислення, відновник HCl;
5 – окислення, відновник HCl;
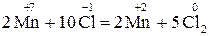 .
.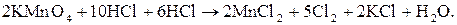 (12)
(12) (13)
(13) . (14)
. (14)
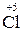 + 6
+ 6 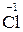 6 2 – відновлення, окисник KClO3;
6 2 – відновлення, окисник KClO3;
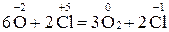 .
. . (15)
. (15) +
+  1 2 – відновлення, окисник HNO2;
1 2 – відновлення, окисник HNO2;
 .
.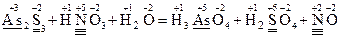 . (16)
. (16) – 4
– 4 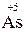 – окиснення
– окиснення – 24
– 24  – окиснення (17)
– окиснення (17)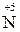 + 3
+ 3 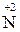 – відновлення
– відновлення
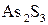 ;
; ;
;

 . (20)
. (20)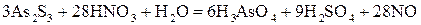 . (21)
. (21)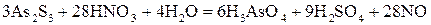 . (22)
. (22)


