ПОГЛОЩЕНИЕ ПРОСТЕТИЧЕСКИХ ГРУПП В БЕЛКАХ
Излучение могут поглощать содержащиеся в молекулах некоторых белков простетические группы (см. рис. 2.3.6). Так, например, гемы, флавины, пиридоксальфосфат и некоторые металлопротеиды обладают интенсивными полосами поглощения в ближней УФ- и видимой областях. По этим полосам, обычно весьма чувствительным к ближайшему окружению простетических групп, можно следить за их состоянием, например за окислением или оксигенацией. Такие хромофоры являются весьма полезными при исследовании многих ферментативных реакций.
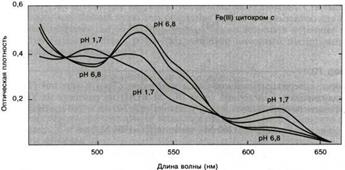
Рис.2.3.6 Спектры поглощения цитохрома с (Fe3+) при различных значениях рН 1.7 – 6.8. С другой стороны, присутствие в белках простетических групп создает и определенные трудности. Почти все хромофоры, которые поглощают в ближней УФ- или видимой областях, имеют столь же интенсивные переходы в интервале от 200 до 300 нм. Если такие хромофоры содержатся в белке в большом количестве, они могут сильно мешать исследованию собственно полипептида. Обойти эту трудность можно, используя апобелки, т.е. белки лишенные простетической группы. Однако при этом нужно быть уверенным, что подобная процедура не искажает структуру полипептидной цепи. Для этого редко бывает достаточно прямых оптических измерений. Если сумма спектров изолированной простетической группы и апобелка совпадает со спектром нативного холобелка, это можно принять как аргумент. Однако, как правило, подобной аддитивности не наблюдается по вполне очевидным причинам (здесь аддитивность скорее исключение из правила, чем правило). Даже в отсутствие конформационных изменений спектры как простетической групппы, так и белка изменяются под действием электронных взаимодействий.
|