КЛАССЫ ХРОМОФОРОВ БИОЛОГИЧЕСКИХ ПОЛИМЕРОВ.
Хромофоры белковых молекул удобно разделить на три класса - это: · пептидные группы, · боковые группы аминокислотных остатков, · простетические группы. Для изучения свойств пептидных хромофоров можно использовать модельные соединения, такие, как формамид или N -метил ацетамид:
Хромофорные белки. Многие белки содержат группы, отличающиеся от обычных аминокислот. Часто, но не всегда, эти группы связаны ковалентными связями с полипептидной цепью. Вот некоторые примеры присоединенных групп: гликопротеины (сахара), гемпротеины (железосодержащие порфирины), флавопротеины (флавины), родопсин (ретиналь; витамин А). В последних трех случаях группа является хромоформом и вносит вклад в спектр поглощения в видимой или ближней УФ области. Родопсин широко распространен в природе в позвоночных и беспозвоночных животных. Родопсин состоит из бесцветного белка (или гликопротеина), опсина, к которому ковалентно присоединена хромофорная оболочка (ретиналь). У млекопитающих изомер 11-цис-ретиналя присоединяется к ε-аминогруппе лизиновой боковой цепи опсина при помощи протонированного основания Шиффа:
11-цис-ретиналь Основание Шиффа Ретиналь — это пример линейных полиенов, которые мы рассмотрели ранее. Шесть сопряженных двойных связей альдегида содержат π-электроны. В результате сопряжения здесь наблюдается значительный батохромный сдвиг π → π* - перехода, что и обуславливает окраску этого хромофора. Излучение могут поглощать содержащиеся в молекулах некоторых белков простетические группы (см. рис. 2.3.6). Так, например, гемы, флавины, пиридоксальфосфат и некоторые металлопротеиды обладают интенсивными полосами поглощения в ближней УФ- и видимой областях. По этим полосам, обычно весьма чувствительным к ближайшему окружению простетических групп, можно следить за их состоянием, например за окислением или оксигенацией. Такие хромофоры являются весьма полезными при исследовании многих ферментативных
|

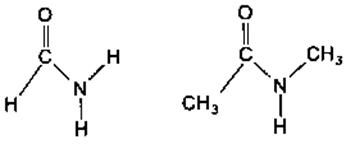 Как известно, электроны пептидной группы в известной мере делокализованы по трем атомам: азоту, углероду и кислороду. Среди наблюдаемых в пептидной группе переходов наименьшую энергию имеет n → π*-переход. Как и в случае формальдегида, n-электрон локализован на атоме кислорода, и этот переход запрещен по симметрии.
Как известно, электроны пептидной группы в известной мере делокализованы по трем атомам: азоту, углероду и кислороду. Среди наблюдаемых в пептидной группе переходов наименьшую энергию имеет n → π*-переход. Как и в случае формальдегида, n-электрон локализован на атоме кислорода, и этот переход запрещен по симметрии.



