ДИАГРАММЫ СОСТОЯНИЯ
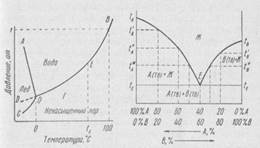
Для наглядности фазовые равновесия представляют в виде диаграмм. На рис.1 схематически изображена такая диаграмма для самого простого случая — однокомпонентной системы уже рассматривавшегося вещества — воды. В качестве параметров естественно взять давление и температуру.
Рис.1. Диаграмма состояния воды Рис.2. Диаграмма состояния. полная растворимость в жидком состоянии, отсутствие растворимости в твердом состоянии
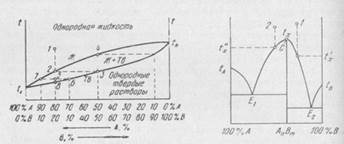
Кривая ОВ отражает зависимость давления пара жидкой воды от температуры, а кривая ОС — давления пара над льдом. Линия OA показывает зависимость температуры замерзания воды от давления (известно, что вода является аномальным веществом, у которого температура замерзания понижается при повышении давления). Пунктирная кривая OD (продолжение ОВ) относится к давлению пара воды, переохлажденной ниже 0° С. Видно, что давление пара переохлажденной воды выше, чем давление льда при той же температуре. Поэтому вода, как уже отмечалось, находится в неустойчивом, или метастабильном состоянии, которого можно достичь лишь осторожным понижением температуры чистой жидкости, не содержащей посторонних частиц. Таким образом, линии ОС и ОВ ограничивают область пара. Между линиями ОС и OA расположена область существования льда, а между линиями OA и ОВ — область существования воды. Любая точка на диаграмме отражает фазовое состояние системы и характеризуется определенным числом степеней свободы. Например, точка Г лежит в области ненасыщенного пара и число степеней свободы равно 2 (С=1—1+2 =2), т. е. в этой области можно произвольно изменять и температуру и давление. Любая точка, лежащая на линии, соответствует равновесию между двумя фазами. Точка Е указывает на равновесие между жидкостью и паром, а число степеней свободы равно единице (С=1—2+2=1). Это означает, что если произвольно задать один из параметров, например, температуру (tE), то второй параметр — давление пара приобретает строго определенное значение в соответствии с кривой ОВ так, чтобы сохранились обе фазы. Если же одновременно произвольно задавать оба параметра, то точка переместится с линии в одну из областей, т. е. исчезнет какая-либо из двух фаз. В точке О, где пересекаются все три кривые, одновременно находятся в равновесии вода, лед и пар. Здесь и температура, и давление фиксированы — число степеней свободы равно нулю (С=1—3+2 = 0). Такие точки называются тройными. В процессах металлургического производства участвуют металлы, содержащие примеси, сплавы, шлаки и другие сложные системы, состоящие из ряда компонентов. Здесь мы ограничимся описанием диаграмм лишь некоторых двухкомпонентных систем, которое полезно для понимания более сложных равновесий, представляющих непосредственный интерес для практики. Металлургам и металловедам особенно важно знать температуры плавления сплавов в зависимости от их состава, а также температуры фазовых превращений в твердой стали, например, превращения аустенит—феррит или температуры растворения карбидов легирующих элементов в аустените. Рассматривая системы, в которых присутствуют лишь твердые и жидкие фазы, как уже отмечалось, правило фаз применяется в виде уравнения (2). Параметрами системы будут только температура и концентрация, так как давление постоянно. Для упрощения графического изображения диаграммы состояния двухкомпонентной системы ось абсцисс, на которой наносят концентрации, ограничена 100%, т. е. соответствует постоянству суммы процентных содержаний обоих компонентов в смеси любого состава. Вследствие этого каждая точка на оси абсцисс отвечает определенному составу смеси. По оси ординат откладывают температуру. На рис.2 представлена простейшая диаграмма состояния двухкомпонентной системы, в которой компоненты А и В в жидком состоянии растворяются друг в друге в любых отношениях, а в твердом состоянии совсем не образуют растворов. Точка tAсоответствует температуре плавления чистого вещества А. Выше этой температуры существует только жидкое вещество А, а ниже — только твердое тело А. В гл. V, посвященной растворам, было показано, что температура замерзания, или, что то же самое, температура плавления вещества понижается при добавлении другого, растворяющегося в нем вещества. Поэтому температура плавления смеси А и В, содержащей, например 20% В, будет ниже tA и составит t'A. По мере увеличения концентрации В температура плавления смеси будет понижаться, например, при 40% В она составит t"A. Очевидно, что при температурах выше точек tA, t'Aи t"A существует лишь однородная жидкость — раствор вещества В в А. При указанных температурах плавления из этого раствора, который становится насыщенным относительно вещества А, начинают выделяться его кристаллы, не содержащие В (из-за полного отсутствия растворимости вещества В в А в твердом состоянии). Ниже температур t'A, fA наряду с кристаллами А продолжает существовать и жидкость. Однако ее состав по мере понижения температуры вследствие выделения из нее вещества Аизменяется — в ней увеличивается концентрация компонента В. Поэтому при дальнейшем понижении температуры и росте содержания В при некоторой температуре tE наступает насыщение раствора относительно не только вещества А, но и В. При этой температуре из жидкости начинают одновременно выделяться кристаллы А и В (кристаллы В также не содержат вещества А). Из диаграммы видно, что такая одновременная кристаллизация обоих веществ происходит лишь при одной определенной температуре tE и определенном составе раствора (40% А+60% В). Ниже этой температуры жидкость полностью исчезает и остается только смесь кристаллов А и В. Итак, рассмотрена часть диаграммы, относящаяся к выделению кристаллов А из расплава. Подобный же вид имеет и другая часть диаграммы. При температуре tB происходит плавление чистого вещества В. Добавление к нему вещества А снижает температуру его плавления. Раствор, содержащий 20% А, плавится при температуре t'B. При температуре tE раствор, который был насыщен веществом В, насыщается и компонентом А, в результате начинается одновременная кристаллизация двух веществ. Таким образом, диаграмму можно разделить на четыре области. Первая область лежит выше двух ветвей tAE и tBE и представляет собой жидкость, в которой оба вещества А и В растворены друг в друге. Выше точки tA состав жидкости может изменяться от 0 до 100% А. Применение правила фаз показывает, что эта область характеризуется двумя степенями свободы (С=К—Ф+1=2—1+2=3), т. е. здесь можно одновременно изменять и температуру, и состав раствора, при этом новые фазы не появятся. Кривые tAE и tBE называются линиями ликвидус (ликвидус по латыни означает «жидкость»), так как они ограничивают область однородной жидкости. При достижении температур и составов, отвечающих этим линиям, начинается выделение кристаллов А или В, т. е. линии tAE и tBE соответствуют равновесию между двумя фазами — жидкой и твердой. При появлении второй фазы число степеней свободы становится равным единице (С = 2—2+1 = 1). Это означает невозможность одновременного изменения температуры и состава при условии сохранения равновесия между двумя фазами. В этих условиях достаточно задать один из параметров, например температуру, чтобы второй параметр (состав) получил бы вполне определенное значение. Так, температуре t"'A соответствует состав жидкости, равновесной с кристаллами А (50% А), а температура t"B характеризует состав жидкости, равновесной с кристаллами В. При понижении температуры до tE слева от точки Е, кроме жидкости и кристаллов А, появляется третья фаза — кристаллы В и число степеней свободы падает до куля (С=2—3+1=0). Это означает, что три фазы могут сосуществовать лишь при единственной температуре tE, при единственном составе жидкости, отвечающем точке Е. Этот состав называется эвтектическим. Как видно из рис. 2, жидкость эвтектического состава отличается самой низкой температурой затвердевания по сравнению с любыми другими смесями веществ А и В. Это свойство эвтектических смесей используется для приготовления легкоплавких сплавов и припоев. Ниже температуры tE жидкость уже не может существовать и охлаждаемый сплав состоит только из двух твердых фаз А и В. Подобная картина наблюдается и справа от точки Е при температуре tE, где к двум фазам — жидкости и кристаллам В добавляются кристаллы А. Очевидно, и здесь жидкость имеет состав, отвечающий точке Е. Ниже горизонтальной линии tEEtE жидкость уже не может существовать. Эта линия называется линией солидус (солидус — твердое тело). К этой области правило фаз уже не применимо, так как кристаллы Аи В представляют собой механическую смесь и равновесия между ними не существует. Диаграммы состояния, подобные рассмотренной выше, образуют, например, серебро и свинец, окись кальция и окись магния, а также некоторые другие системы. Однако полная взаимная нерастворимость двух веществ в твердом состоянии встречается сравнительно редко. Чаще наблюдается образование более или менее ограниченных твердых растворов. На рис.3 представлена диаграмма состояния для двух веществ, которые неограниченно растворяются друг в друге как в жидком, так и твердом состояниях. Здесь и tB — температуры плавления чистых веществ А и В, соответственно. В отличие от предыдущей диаграммы с двумя ветвями линии ликвидус, здесь эта линия представлена одной плавной кривой tAЖtB. Выше ее существует однородный жидкий раствор. Линия солидус передается кривой tATetB. При температурах ниже этой линии лежит область твердых растворов, состав которых не ограничен, т. е. они однородны при всех концентрациях от 0 до 100% А. Рассмотрим процесс охлаждения какого-либо раствора (или сплава), содержащего, например, 80% более легкоплавкого вещества А. При температуре в точке 1 раствор находится в жидком состоянии. Охлаждение его до температуры точки 2 вызывает кристаллизацию. Однако из раствора выделяется не чистое вещество А и не чистое вещество В, а образуется твердый раствор этих двух веществ. Это наблюдается, когда оба вещества кристаллизуются в схожих пространственных решетках и их атомы легко заменяют друг друга в узлах общей решетки, т. е. образуется твердый раствор А и В. Таким образом, в точке 2 в равновесии находится две фазы — жидкий раствор В в А(концентрация В равна 20%) и твердый раствор с концентрацией В, равной 50%. Согласно правилу фаз, число степеней свободы составляет единицу. Это означает, что, если задан параметр — t, то другие параметры определяются автоматически.
Рис. 3.Диаграмма состояния. Полная Рис.4 Диаграмма состояния. растворимость в жидком и твердом Образования химического состояниях соединения В рассматриваемом случае имеется еще два параметра — концентрации жидкого и твердого растворов, которые имеют определенные значения. Из рис.3 видно, что выбранной температуре отвечает концентрация твердого раствора в точке 3, составляющая около 50% В. Видно, что твердый раствор обогащен по сравнению с жидким более тугоплавким веществом В. Это свойство используется при разделении некоторых металлов, например серебра и золота, образующих твердые растворы. Действительно, если отделить первую порцию кристаллов состава точки 3, а затем их вновь расплавить, то при температуре точки 4 будет кристаллизоваться сплав, сильно обогащенный компонентом В (около 90%). Отметим, что добавление вещества В к Ане понижает, а повышает температуру плавления. Вернемся к нашему раствору в точке 2. При его дальнейшем охлаждении естественно будет увеличиваться количество твердого раствора. При этом состав жидкости обогащается легкоплавким веществом А, а состав кристаллов — веществом В, как это показано на рис.3 для температуры точки 5, где составы сосуществующих растворов отвечают точкам 6 и 7. Таким образом, в области между кривыми ликвидус и солидус существует двухфазное равновесие между двумя сопряженными растворами — жидким и твердым. Если кристаллизация сплава, образованного металлами, дающими твердые растворы, происходит сравнительно быстро, то слиток может получиться неоднородным по химическому составу. Такое явление называется сегрегацией. Если же кристаллизация ведется очень медленно и концентрации твердых растворов успевают выровняться, то, естественно, что состав сплава, затвердевшего при температуре точки 8 по всему объему, в точности отвечает составу первоначального жидкого сплава (точка 1). Отметим, что неограниченная растворимость в твердом состоянии в действительности встречается относительно редко — в системах, образованных близкими по своим свойствам веществами. Чаще всего наблюдается ограниченная растворимость твердых веществ друг в друге. Диаграмма состояния двух веществ, образующих химическое соединение, показана на рис.4. Образующееся прочное химическое соединение АпВт имеет высокую температуру плавления tx. Раствор в точке 1содержит вещества В больше, чем необходимо для образования химического соединения. Этот избыток понижает его температуру плавления до t'x. Подобным же образом избыток вещества А (точка 2) снижает температуру плавления соединения до t"x. Это полностью подобно характеру диаграммы состояния на рис.2. Линии СЕ1 и СЕ2 являются линиями ликвидус, указывающими температуры и составы жидких растворов, из которых кристаллизуется химическое соединение. Точки Е1 и Е2 отвечают составам и температурам эвтектических смесей, образованных химическим соединением и веществом Ав первом случае и веществом В во втором. Присутствие в растворе химического соединения в свою очередь понижает температуру плавления как вещества А, так и вещества В. Кривые tA Е1 и tBE2 представляют собой линии ликвидус, соответствующие кристаллизации веществ А и В. Диаграмму состояния, изображенную на рис.4, можно рассматривать как отдельные диаграммы для двух систем А — АnВm и АnВm—В с полным отсутствием растворимости в твердом состоянии (см. рис.2), если разрезать ее по вертикальной линии САnВm. Таким образом, существование максимума на кривой ликвидус свидетельствует об образовании химического соединения между веществами Аи В. Диаграммы состояния реальных металлургических систем обычно бывают более сложными, но содержат в себе части, подобные описанным выше. Приведем краткое описание двух таких систем. Одна из них имеет важнейшее значение для понимания процессов производства чугуна и стали, а также их термической обработки. Это — диаграмма состояния сплавов железа с углеродом (рис.5).
Рис.5. Диаграмма состояния железо - углерод. Пунктиром показаны линии выделения не цемента, а графита
При 1539° С чистое жидкое железо затвердевает, образуя кристаллы модификации δ-железа со структурой объемноцентрированного куба, при температуре около 1392° С эта модификация превращается в γ-железо (гранецентрированный куб), которая существует до 911° С. Ниже этой температуры она вновь превращается в объемноцентрированную модификацию α-железа. Существование этих полиморфных превращений является одним из наиболее важных свойств железа. Не менее важно и большое различие в растворимости углерода в α- и в γ-модификациях. Твердый раствор углерода в γ-железе, который называется аустенитом, может содержать до 2,14% (по массе) углерода при 1153° С. Раствор же углерода в низкотемпературной α-модификации (феррит), может быть только очень разбавленным и содержать не более 0,03% (по массе) углерода при 738° С. Поэтому, если аустенит с относительно большим содержанием углерода быстро охладить, то образуется пересыщенный раствор углерода в α-железе, отличающийся высокой твердостью. Он называется мартенситом. Эти свойства обеспечивают способность стали подвергаться закалке и наряду с другими свойствами железа — пластичностью, твердостью, высокой температурой плавления — обусловили его исключительную роль в развитии материальной культуры человечества. Рассмотрим некоторые особенности диаграммы состояния железо — углерод. Добавление углерода понижает температуру плавления железа. При относительно малых концентрациях углерода из расплава выделяется не чистое железо, а разбавленный твердый раствор углерода в δ-железе. Эта область соответствует двухфазному равновесию расплав + твердый δ-раствор (феррит). Охлаждение этого раствора приводит к его превращению в аустенит. В случае несколько более высокой концентрации углерода при охлаждении сплава после прохождения через двухфазную область жидкий сплав + феррит сплав представляет собой однородный твердый γ-раствор, который устойчив до точки О на кривой GS. Ниже этой температуры происходит распад — из него выделяется твердый α-раствор (феррит) состава, отвечающего точке М. При температуре 738° С (так называемая эвтек- тоидная температура) при охлаждении сплава происходит превращение аустенита в феррит. Наконец, ниже 738° С аустенит полностью исчезает, а оставшийся феррит при дальнейшем понижении температуры распадается, с образованием карбида железа Fе3С (цементита). При этом содержание углерода в α-твердом растворе уменьшается с понижением температуры. При еще более высоких концентрациях углерода (~0,8%) при остывании расплава при температуре ~ 1460°С из него выделяется твердый раствор углерода в γ-железе (аустенит), содержание углерода в котором ниже — менее 0,7%.
Рис.6. Диаграмма состояния системы Al2O3 – SiO2 Область аустенит — жидкость отвечает двухфазному равновесию. Дальнейшее охлаждение приводит к полному затвердеванию и ниже ~ 1300° С существует только аустенит. Он устойчив при охлаждении до температуры на кривой SE, ниже из твердого γ-раствора обычно начинается выделение цементита и при температуре меньше 738° С аустенит полностью распадается. При концентрациях углерода больших 4,26% (по массе) из расплава выделяется карбид железа. Эта концентрация соответствует температуре эвтектического сплава железа и его карбида Fe3C. Отметим сходство некоторых частей диаграммы состояния железо — углерод с рассмотренными ранее простыми диаграммами состояния. В соответствии с правилом фаз в системе при равновесии не может существовать более трех фаз. Например, при концентрации углерода 0,765% и температуре 738°С существуют одновременно феррит, цементит и аустенит (эвтектоидная точка), а при концентрации 2,14% и температуре 1147° С сосуществуют аустенит, расплав и цементит. Приведем в качестве еще одного примера высокотемпературную часть двухкомпонентной системы кремнезем— глинозем (рис.6), представляющий интерес для технологии силикатных и огнеупорных материалов. Здесь отсчет температур начинается приблизительно с 1400° С. При высоких температурах кремнезем устойчив в виде полиморфной модификации кристобалита, а глинозем — в виде корунда. Из рис.6 видно, что в этой системе образуется одно химическое соединение — муллит (ЗА120з • 2S1O2), плавящееся выше 1800° С. Из рис.6 также видно, что кристобалит и муллит, с одной стороны, и корунд и муллит — с другой, не образуют друг с другом твердых растворов.
|