Соединения азота в степени окисления –3
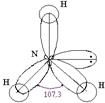
При высоких температурах азот окисляет многие неметаллы и металлы, образуя нитриды: 3Mg+N2=Mg3N2 3B+N2=2BN 3H2+N2 Аммиак NH3 представляет собой бесцветный газ с характерным запахом, почти в два раза легче воздуха. Будучи охлажден до –330 С, он сжижается при обыкновенном давлении, а при –78 0 С затвердевает. Молекула NH3 имеет форму тригональной пирамиды с углом связи 107,30. Вследствие sр3-гибридизации валентных орбиталей атома азота, не связывающее электронное облако отчетливо ориентированно в пространстве:
Поэтому молекула NH3 – резко выраженный донор электронной пары и обла- дает высокой полярностью ( H N…H-N…H-N… - ассоциированная молекула аммиака H H H Аммиак очень хорошо растворим в воде: в одном объеме воды при 20 °С растворяется 700 объемов аммиака, а при О °С − около 1200 объемов. Высокая растворимость аммиака в воде обусловлена возникновением водородных связей между молекулами аммиака и воды: NH3+H2O Появление гидроксильных групп создает щелочную среду. Но, как видно из значения константы ионизации, эта реакция протекает в незначительной степени:
10 %-й раствор аммиака в воде называют нашатырным спиртом.
|

 2NH3.
2NH3.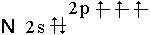
 =1,46 Д). Наличие связывающей электронной пары и высокая полярность связи N-H обуславливают между молекулами водородную связь. Поэтому температура плавления и кипения аммиака довольно высокая, он легко сжижается и имеет высокую теплоту испарения. На этом основано его применение в холодильных машинах.
=1,46 Д). Наличие связывающей электронной пары и высокая полярность связи N-H обуславливают между молекулами водородную связь. Поэтому температура плавления и кипения аммиака довольно высокая, он легко сжижается и имеет высокую теплоту испарения. На этом основано его применение в холодильных машинах. H2O
H2O 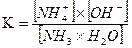 =1,8.10-5.
=1,8.10-5.


