Азотистоводородная кислота, азиды металлов
Азотистоводородная кислота HN3 − бесцветная летучая жидкость с резким запахом. Водный раствор HN3 − кислота близкая по силе к уксусной (К=1,8.10-5), в разбавленных растворах устойчива. Ее получают взаимодействием гидразина и азотистой кислоты N2H4+HNO3=HN3+2H2O. Азид-йон в соответствии с sр -гибридизацией валентных орбиталей N+ имеет линейную форму с одинаковой длиной связей N-N, dNN= 1,15 А°:
Соли азотисто водородной кислоты − азиды − при ударе или нагревании рас-падаются со взрывом. На этом основано применение азида свинца Рb(N3)2 в качестве детонатора. Относительно устойчивы ионные азиды, которые при нагревании разлагаются без взрыва: 2Nа N3 N2 = 2Nа +3N2 По окислительным свойствам НNN2 напоминаем азотную кислоту:
1 Cu – 2e = Cu2+ 1 НNN2 + 2e + 2H+ = N2 + Н3N Cu + НNN2 + 2H+= Cu2+ + N2 + Н3N
|

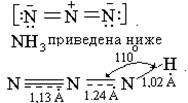
 Cu + 3НNN2 = Cu (NN2)2 +N2 + Н3N
Cu + 3НNN2 = Cu (NN2)2 +N2 + Н3N


