Оксид азота (III), азотистая кислота и ее соли - нитриты
Оксид азота (III) - N2O3 существует только в твердом состоянии при низких температурах. В виде жидкости и пара в значительной степени диссоциирован: N2O3 Его получают охлаждением смеси NO2 и NO. Согласно данным, полученным с помощью инфракрасной спектроскопии, полагают, что кристаллы N2O3 состоят из стабильной и нестабильной модификации: O N N O = N –N O O O. O Азотистая кислота получается при взаимодействии нитрита натрия с разбав-ленной серной кислотой: NaNO2+H2SO4=NaHSO4+HNO3. Это слабая кислота (К = 5.10-4), существует только в очень разбавленных растворах, а потому сравнительно легко разлагается: 2HNO2=N2O3+H2O. Для HNO2 вероятны две таутомерные структуры
Нитрит-ион имеет угловую форму
Нитриты − соли азотистой кислоты − устойчивы. Наибольшее практическое значение имеет нитрит натрия, используемый в производстве красителей и лабораторной практике. Нитриты могут быть получены пропусканием эк-вимолярной смеси оксидов азота (II) и (IV) в раствор щелочи NO+NO2+2NaOH=2NaNO2+H2O. Производные азота (III) проявляют восстановительные и окислительные свойства: 2NaNO2+2KJ+2H2SO4=J2+2NO+K2SO4+Na2SO4+2H2O
1 2J- -2e= J2 2 NO-2+2H++ 2J- =2 NO+2H2O + J2 5NaNO2+2KMnO4+3H2SO4=2MnSO4+5NaNO3+K2SO4+3H2O 5 NO2ˉ+H2O-2e=NO3ˉ+2H+ 2 MnO4ˉ +8H+ + 5е = Mn2+ +4H2O 5NO2ˉ+5H2O+ 2MnO4ˉ +16H+=5NO3ˉ+10H++2Mn2++8H2O Кроме того, они склонны к реакциям диспропорционирования: 3HNO2=HNO3+NO2+H2O.
|

 NO2+NO; DG0298=1,8 кДж.
NO2+NO; DG0298=1,8 кДж.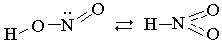
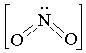
 2 NO-2+2H++1e=NO+H2O
2 NO-2+2H++1e=NO+H2O


