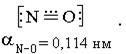Кислородные соединения азота
Оксид азота (I) N2O − бесцветный газ со слабым, приятным запахом и сладким вкусом. Вдыхание его вызывает состояние опьянения, потерю болевых ощущений, поэтому он нашел применение в медицине в качестве анестезирующего средства. Этот оксид азота можно получить разложением нитрата аммония при 250 0С: NH4NO3=N2O+ H2O. Oксид растворяется в воде, но устойчивых соединений не образует. При комнатной температуре устойчив, при нагревании выше 500 °С разлагается: 2N2O=t2N2+O2. Оксид азота (I) - безразличный оксид. Структурную формулу этого оксида можно изобразить следующим образом:
В соответствии с sр -гибридизацией валентных орбиталей N+ молекула имеет линейное строение, Можно также рассматривать структурную формулу оксида с точки зрения образования центральным атомом азота донорно-акцепторной связи:
Центральный атом представляет для связи два неподеленных электрона. Эта связь изображается стрелкой, направленной от донора к акцептору: O=N=N Оксид азота (П) представляет собой бесцветный газ без запаха, мало-растворимый в воде, на воздухе он легко окисляется 2NO+O2=NO2. Это эндотермическое соединение DG298= 90 (кДж/моль). Оксид азота (II) относится к безразличным оксидам. В природе NO образуется при грозовых разрядах по цепной реакции: N2+O2=2NO2, DG=-35,7 кДж В промышленности получают каталитическим окислением аммиака в при-сутствии платины и оксидов железа и хрома 4NH3+5O2=4NO+6H2O. В лаборатории NO образуется при действии на медь разбавленной азотной кислоты 3Cu+8HNO3 разб.= 3Cu(NO3)2+2NO+4H2O Молекула NO парамагнитная. Согласно методу молекулярных орбиталей, один из электронов в молекуле находится на
Оксид азота (П) легко окисляется галогенами, образуя гадогениды нитрозила: 2NO+Cl2=NOCl. Молекула NO выступает как лиганд в разнообразных комплексах, называе- мых нитрозильными.
|


 =0,17 Д.
=0,17 Д.
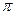 рразр -орбитали, порядок связи составляет 2,5. Структурную формулу можно изобразить следующим образом:
рразр -орбитали, порядок связи составляет 2,5. Структурную формулу можно изобразить следующим образом: