Распространение в природе
Содержание азота на Земле составляет 0,03 мол. доли, %. Основная его масса входит в состав атмосферы (78 объемных долей, %)в виде простого вещества, из минералов промышленное значение имеют NaNO3 - чилийская и KNO3- индийская селитры. Азот входит в состав белковых тел всех растительных и животных организмов. Природный азот состоит из двух стабильных изотопов 14N и 15N. Азот представляет собой газ без цвета и запаха с температурой плавления − 209,86 °С и температурой кипения 195,8 °С. Растворимость азота в воде незначительна. Молекула азота двухатомна (N2), и атомы в ней связаны одной
Азота химически малоактивен. При повышенной температуре он реагирует с кальцием и некоторыми другими металлами. С кислородом при 3000 0С азот образует оксид азота (II) NO. С водородом он взаимодействует только при повышенном давлении и при участии катализаторов. С галогенами и серой азот непосредственно не соединяется, а с раскаленным коксом образует дициан (CN)2. В промышленности азот получают фракционной перегонкой жидкого воздуха. В лаборатории азот получают термическим разложением нитрита аммония: NH4NO2=N2+2H2O.
|

 и двумя
и двумя 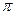 -связями, dN=N = 1,095 А°. Энергия ее диссоциации − 940 кДж/моль, вследствие этого молекула N2 очень прочна.
-связями, dN=N = 1,095 А°. Энергия ее диссоциации − 940 кДж/моль, вследствие этого молекула N2 очень прочна.



