Степень окисления –2
С водородом сера образует ряд соединений общей формулы H 2Sn, которые называют сероводородами или сульфанами. Простейший из наиболее важных представителей сульфанов H2S - сероводород. Его обычно получают при прямом синтезе из серы и водорода при повышенной температуре S+H2 В лабораторных условиях при действии кислот на сульфиды металлов: FeS+2HCl=FeCl2+H2S Достаточно чистый сероводород можно получить реакцией гидролиза сульфида алюминия: Al2S3+6H2O=2Al(OH) 3+3H2S Сероводород – это бесцветный газ, с неприятным запахом «тухлых яиц», очень ядовит, температура кипения 60 0С, температура плавления – 86 0С. Молекула Н2S имеет угловую форму, угол связи равен 920. Н2S обладает восстановительными свойствами. На воздухе горит:
2H2S+3O02=2SO2+2H2O При ограниченном доступе воздуха реакция протекает по уравнению:
2H2S+O2=2S0 В присутствии сильных окислителей H2S окисляется, в зависимости от условий реакции, до свободной серы или до сульфат-иона: -2 +6 +3 3H2S+K2Cr2O7+4H2SO4=3S0
1 Cr2O72-+6e+14H+=2Cr3++7H2O 3H2S+Cr2O7 2-+8H+=3S+2Cr3++7H2O -2 -1 +6 3H2S+4HCl+5O3 В воде сероводород довольно хорошо растворим (3 об.ч. на I об.ч.H2O при 20 °С), при этом образуется слабая двухосновная киcлота: H2S HS- Кислые соли, содержащие ион НS- называются гидросульфидами, средние соли сероводородной кислоты называют сульфидами, большинство сульфидов малорастворимы в воде (кроме сульфидов щелочных металлов и аммония) и ярко окрашены, например, CuS, NiS, РbS-черного цвета, CdS-желтого цвета, MnS - телесного, ZnS- белого цвета. Это свойство сульфидов широко используется в аналитической химии. Получают сульфиды реакциями обмена в растворе: MnCl2+Na2S=MnS NiCl2+H2S=NiS Сульфиды, как и оксиды можно разделить на кислотные, основные и амфотерные. Изменение характера сульфидов можно проследить по изменению реакции среды при гидролизе: Na2S+H2O Cr2S3+6H2O=2Cr(OH)3+3H2S. Р2S5+8HOH При взаимодействии основных и кислотных сульфидов приводят к образованию тиосолей: Al2S3+3Na2S=2Na3 AlS4.
|

 H2S.
H2S.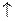 .
.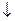 +2H2O
+2H2O 3 H2S-2e=S+2H+
3 H2S-2e=S+2H+ 4HCl+3H2SO4.
4HCl+3H2SO4. H++HS- (Kg / =1 10-7)
H++HS- (Kg / =1 10-7)


