Ізотерма адсорбції (закон) Генрі
Припустимо, що тверда поверхня на якій відбувається адсорбція, є однорідною і в результаті адсорбції на ній утворюється мономолекулярний шар адсорбованих молекул. Якщо вважати поверхневий шар окремою фазою то можна розглядати адсорбцію, як процес вирівнювання хімічних потенціалів речовини, що адсорбується на поверхні і в об’ємі системи. Хімічний потенціал компонента в об’ємі дорівнює: mv = mvo + RTlnav (4.27) av = cgv – активність компонента в об’ємі системи. Хімічний потенціал компонента на поверхні:
a = Аg – активність компонента на поверхні. А – адсорбція (концентрація на поверхні). В стані рівноваги хімічний потенціал компонентів в об’ємі і поверхневому шарі вирівнюється. mvo + RTlnav = mo + RTlna (4.29)
КГ – константа Генрі (не залежить від концентрації).
При значеннях концентрації близької до нуля gv ≈ g ≈ 1, в цьому випадку одержуємо рівняння ізотерми адсорбції Генрі: А=КГс, або А=КГр (4.34) Величина адсорбції при малих значеннях тиску або концентрації прямо пропорційна тиску або концентрації.
Рис. 20. Ізотерма адсорбції Генрі.
Ізотерма адсорбції Генрі описує адсорбцію на однорідній поверхні в мономолекулярному шарі при малих значеннях тиску або концентрації. Відхилення від прямої лінії при збільшенні тиску або концентрації обумовлене зменшенням числа вільних адсорбційних центрів на поверхні адсорбенту, та впливом коефіцієнтів активності системи.
|

 m = mo + RTlna (4.28)
m = mo + RTlna (4.28)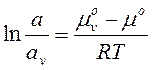 (4.30)
(4.30) (4.31)
(4.31)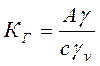 (4.32)
(4.32)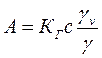 (4.33)
(4.33)



