Природа адсорбційних сил
Рушійною силою перерозподілу компонентів між об’ємом і поверхневим шаром є вирівнювання їх хімічних потенціалів в об’ємі та у поверхневому шарі. Розрізняють фізичну, або ван-дер-ваальсову, адсорбцію та хімічну, або хемосорбцію. Перша - оборотна, друга - необоротна. При хімічній адсорбції молекули зв’язуються з адсорбентом міцними хімічними зв’язками, внаслідок чого адсорбовані молекули втрачають рухливість. Хемосорбція з ростом температури зростає, а фізична адсорбція, навпаки, зменшується. Теплота хімічної адсорбції складає 40 – 400 кДж/моль, а фізичної адсорбції 8 – 40 кДж/моль. При підвищенні температури фізична адсорбція може переходити в хемосорбцію. При фізичної адсорбціїдіють сили притягання (сили Ван-Дер-Ваальса і водневі зв’язки) та сили відштовхування. Сили Ван-Дер-Ваальса поділяються на: 1. Сили Лондона або дисперсійні сили, проявляються між будь-якими молекулами і виникають внаслідок того, що миттєві флуктуації електронної густини в одній молекулі індукують зміну електронної густини в сусідній, в результаті чого відбувається взаємодія між молекулами. 2. Сили Дебая зумовлені взаємодією дипольного моменту однієї з молекул з індукованим нею дипольним моментом іншої молекули. 3. Сили Кеєзома зумовлені безпосередньою взаємодією між постійними дипольними моментами молекул. Для всіх трьох сил залежність енергії притягання від відстані описується однаковим за формою рівнянням.
С – коефіцієнт, який залежить від природи сил; r – відстань між атомами. На дуже близьких відстанях суттєвим стає вплив сил відштовхування
m - ціле число; b – стала сил відштовхування. В більшості випадків сумарну енергію взаємодії між двома атомами задовільно описує рівняння Леннарда - Джонса, в якому m=12.
При адсорбції відбувається взаємодія між атомом (молекулою) адсорбату з поверхнею адсорбенту. Дія дисперсійних сил є адитивною, тобто атом адсорбату взаємодіє зі всією поверхнею адсорбенту. Умовно виділимо в об’ємі адсорбенту сферичний сегмент радіуса r і товщиною dr, відстань від атома адсорбату до поверхні адсорбенту x (рис.15).
Рис. 15. Схема взаємодії атома з поверхнею.
Розрахуємо енергію притягання атома адсорбенту атомами сферичного сегменту поверхні.
n – кількість атомів у сферичному сегменті. Величину dV можна виразити через поверхню сферичного сегменту: S = 2prh = 2pr(r – x) (4.6) dV = Sdr = 2pr(r – x)dr (4.7)
Енергію притягання атома до сферичного сегмента поверхні дорівнює:
Тобто енергія притягання при взаємодії атома з поверхнею зменшується з відстанню пропорційно третій степені, тоді як при взаємодії двох атомів – пропорційно шостій степені. Загальна енергія взаємодії при адсорбції дорівнює:
Енергія притягання прямо пропорційна кількості атомів адсорбату і адсорбенту, що приймають участь в акті адсорбції, тому: 1. Енергія притягання в порах і тріщинах є більшою по відношенню до рівної поверхні. 2. Чим з більшої кількості атомів складається молекула адсорбату, тим сильніше вона притягається до поверхні адсорбату. На рис.16 проілюстрована залежність потенційної енергії взаємодії двох атомів (лінія 1), та атома з поверхнею (лінія 2).
Рис. 16. Енергія взаємодії двох атомів (1) та атома з поверхнею (2).
|

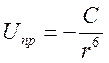 (4.2)
(4.2) (4.3)
(4.3)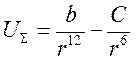 (4.4)
(4.4)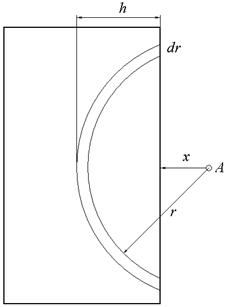
 (4.5)
(4.5) (4.8)
(4.8) (4.9)
(4.9) (4.10)
(4.10)



