Іонна адсорбція
Іонна адсорбція завжди відбувається тільки на полярних адсорбентах, вона як правило незворотна і зростає із збільшенням температури, що вказує на хімічну природу сил, що діють між іонами та адсорбентом. Іони з певним знаком заряду адсорбуються на мікроділянках поверхні адсорбенту з протилежним знаком заряду. Якщо в розчині електроліту є різні іони з однаковим знаком заряду то, відбувається вибіркова (селективна) адсорбція. Згідно правила вибіркової адсорбції Панета - Фаянса перевагу при адсорбції мають іони, які входять до складу кристалічної ґратки твердої поверхні. Ці іони здатні добудовувати кристалічну ґратку поверхні. Такі іони називають родинними іонами. Наприклад, на поверхні кристалів AgI, що знаходяться в розчині KI, першочергово будуть адсорбуватися іони I-. Добудовувати кристалічну ґратку можуть не тільки родинні іони, але і ізоморфні з ними, тобто іони з близькою до них структурою. Наприклад, на поверхні кристалів AgI, що знаходяться в розчині KCl, будуть переважно адсорбуватися іони Cl-. При адсорбції з розчину неродинних (індиферентних) іонів перевагу мають іони з більшою валентністю. Чим більше валентність іона, тим сильніше він притягується протилежно зарядженими мікро ділянками поверхні. K+<<Ca2+<<Al3+<<Th4+ З іонів з однаковою валентністю краще адсорбуються іони з більшим іонним радіусом. Чим більший радіус іона, тим менше він поляризований і тим тонша його гідратна оболонка.
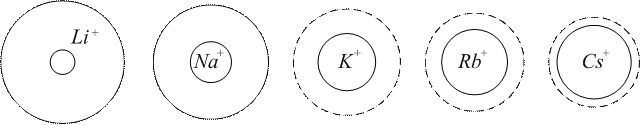
Рис. 34. Співвідношення між дійсними та гідратованими радіусами іонів.
Іони з однаковою валентністю, розташовані в порядку зростання їх адсорбційної здатності, називають ліотропними рядами, або рядами Гофмейстера. Li+<Na+<K+<Rb+<Cs+ Mg2+ <Ca2+ <Sr2+ <Ba2+ F-<Cl-<Br-<I-
Якщо на поверхні адсорбенту попередньо були адсорбовані іони, то при введенні в розчин нових іонів можлива обмінна адсорбція. При цьому адсорбент буде поглинати певну кількість іонів з розчину і одночасно виділяти в розчин еквівалентну кількість іонів того самого знаку. Обмінну адсорбцію іонів на поверхні характеризує рівняння Нікольского:
g1, g2 – кількості 1-го та 2-го іонів на поверхні адсорбенту; с1, с2 – концентрації іонів; z1, z2 – заряди іонів; k – константа рівноваги реакції іонного обміну. Обмінна адсорбція має велике значення в природі та техніці. Природні ґрунти здатні поглинати деякі іони, наприклад K+, NH4+, і виділяти еквівалентні кількості інших катіонів, наприклад Ca2+, Mg2+. Іонообмінну адсорбцію використовують для пом’якшення води. З цією метою використовують синтетичні та природні іоніти – речовини, що здатні до іонного обміну.
|

 , де (4.71)
, де (4.71)


