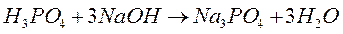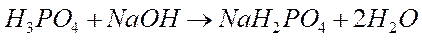Основные стехиометрические законы химии
Стехиометрия – раздел химии, рассматривающий количественные соотношения между реагирующими веществами. Закон сохранения массы: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. Закон постоянства состава: всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Закон применим только к соединениям с молекулярной структурой. Закон эквивалентов: массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ. Например, в условной реакции А + 2В = 3С + Д mА : mВ: mС: mД = ЭА: ЭВ: ЭС: ЭД, где m – масса веществ, а Э – молярная масса эквивалентов. Другими словами можно сказать, что вещества реагируют и образуются в эквивалентных количествах. Один эквивалент одного вещества всегда взаимодействует с одним эквивалентом другого. Эквивалент – реальная или условная частица, которая может присоединять, высвобождать или быть каким–либо другим образом эквивалентна одному иону водорода в кислотно–основных реакциях или одному электрону в окислительно–восстановительных реакциях. При использовании понятия «эквивалент» всегда необходимо указывать, к какой ионной реакции оно относится.
|