Раздел 5. ФИЗИОЛОГИЯ ПИЩЕВАРЕНИЯ
Ферменты, будучи биологическими катализаторами, обладают т.н. субстратной специфичностью, т.е. способностью выявлять определенные субстраты и взаимодействовать только с ними. На этой модели Вы сможете убедиться в субстратной специфичности основных ферментов ЖКТ (амилолитических, липолитических и протеолитических), изучить влияние на их активность рН и температуры. Модельная установка включает термостат для инкубации растворов, набор необходимых реактивов, пробирки и блок регистрации результатов.
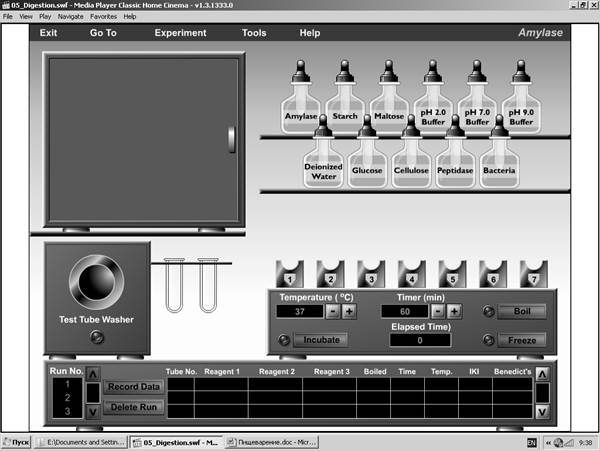
Работа №1. ИЗУЧЕНИЕ СУБСТРАТНОЙ СПЕЦИФИЧНОСТИ АМИЛАЗЫ. Рис. 27. Оборудование для изучения субстратной специфичности амилазы
Амилаза слюны является гликолитическим ферментом, основные субстраты которого – полисахариды крахмал и гликоген. Наиболее эффективен он при температуре 37-380С и слабощелочной среде (рН 8). Цель эксперимента: продемонстрировать субстратную специфичность амилазы слюны и выявить оптимальные условия для ее работы. Принцип действий: амилазу смешивают с тремя углеводами, которые обладают разной структурой. Для выявления моносахаридов используется реакция Бенедикта, реактив IKI, содержащий йод, используется для выявления в растворах полисахаров (крахмала). В набор реактивов на полке входят: 1) ферменты: амилаза (Amylase), крахмал (Starch), пептизаза (Peptidase), бактерии (Bacteria); 2) субстраты: мальтоза (Maltose), дистиллированная вода (Deionized water), глюкоза (Glucose), целлюлоза (Cellulose), 3) три буферных раствора с рН 2, pH 7 и pH 9. Вы имеет возможность поместить три раствора (по одному из каждой группы) в пробирку, которая извлекаются из держателя и помещается в инкубатор. Число проб может быть от 1 до 7. Основное правило: в каждой пробирке должно быть смешано три раствора. Составьте план эксперимента: какие субстраты и какие ферменты Вы будете смешивать, и при какой величине рН. Например: Пробирка 1. Крахмал + амилаза + рН 9; Пробирка 2. Глюкоза + амилаза + рН 9; Пробирка 3. Целлюлоза + амилаза + рН 9; Пробирка 4. Целлюлоза + бактерии + рН 7; Пробирка 5. Крахмал + пептидаза + рН 2; Пробирка 6. Мальтоза + амилаза + рН 9 Пробирка 7. Крахмал + вода + рН 7; Алгоритм действий: 1. Установите время инкубации (по умолчанию оно составляет 60 мин). Если Вы хотите исследовать влияние времени инкубации на гидролиз субстратов – измените его так, как Вам нужно. 2. С помощью мышки захватите 1-ю пробирку из контейнера и поместите на штатив инкубатора. С помощью пипетки наполните ее субстратом (крахмалом), добавьте фермент (амилазу) и буфер с рН = 9 (вспомните, что наибольшую активность амилаза проявляет в щелочной среде). 3. Захватите 2-ю пробирку из контейнера и поместите ее в штатив. Наполните ее растворами в соответствии с Вашим планом эксперимента. 4. Повторяйте эти шаги, пока не заполните все места в штативе. 5. Нажмите кнопку Incubate для начала инкубации растворов в термостате. После окончания выставленного времени пробирки появятся из термостата, и откроется штатив с контрольными реактивами. 6. С помощью мышки захватите первую пробирку и отлейте из нее часть раствора в первую пробирку в контрольном штативе. Повторите это для каждой следующей пробирки. 7. В каждую контрольную пробирку добавьте с помощью мышки по капле реактива IKI, который содержит йод. Почернение раствора в пробирке укажет на присутствие в нем полисахарида (крахмала). 8. Добавьте по капле реактива Бенедикта (Benedict) в каждую из пробирок, находящихся в штативе инкубатора. Затем включите кипячение (кнопка «Boil» справа от указателя времени). Возможные всплывающие подсказки при нарушении технологии эксперимента: Before boiling, a test tube must be filled with the correct number of reagents and lowered into the incubation unit (Перед кипением, испытательная труба должна быть заполнена правильным числом реактивов и подвергнута инкубации) The following test tubes do not contain the proper number of reagents (Следующие испытательные трубы не содержат надлежащее количество реактивов) Benedict’s solution has already been dispensed to this tube (Реактив Бенедикта был уже добавлен в эту трубу) Изменение окраски раствора укажет на наличие в нем моносахарида (глюкозы). Нажмите «Record date» для регистрации результатов эксперимента. Перепишите эти данные в тетрадь и сделайте вывод о субстратной специфичности амилазы и влиянии на ее активность рН и времени инкубации.
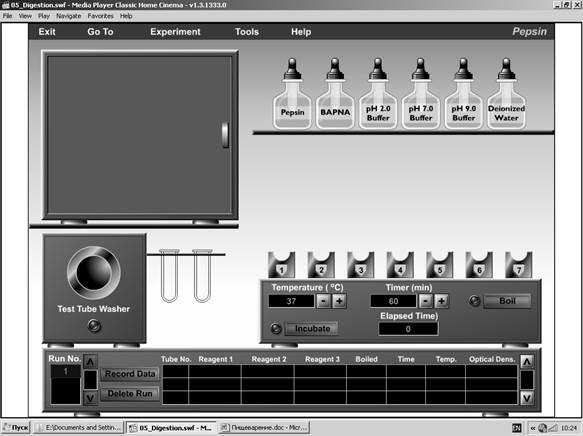
Работа №2. ИЗУЧЕНИЕ СУБСТРАТНОЙ СПЕЦИФИЧНОСТИ ПЕПСИНА.
Пепсин является протеолитическим ферментом, который синтезируется основными клетками желудочных желез в виде неактивного пепсиногена. Когда рН содержимого желудка становится ниже 5, пепсиноген превращается в пепсин. Происходит это благодаря присутствию с желудочном сока соляной кислоты. Наибольшую активность пепсин проявляет при рН 2. Цель: продемонстрировать влияние уровня рН на активность пепсина. Принцип действий: инкубирование в течение 3 часов пепсина и яичного белка при 38оС вместе с соляной кислотой и без нее. Определение степени переваривания белка (по уменьшению его размеров). В набор реактивов для этого опыта входят пепсин, куриный белок (ВАРНА), вода и буферные растворы с рН 2, 7, 9. Прежде, чем начинать эксперимент, составьте план опыта. Вы можете максимально использовать 7 пробирок, в которых должны быть смешаны 3 реактива. Вы можете также менять время инкубации (максимально до 90 мин) и температуру в термостате. Один из вариантов опыта: Пробирка 1. Белок + пепсин + рН 2. Пробирка 2. Белок + пепсин + + рН 7. Пробирка 3. Белок + пепсин + рН 9 Пробирка 4. Белок + вода + рН 2. Пробирка 5. Белок + вода + рН 7. Пробирка 6. Белок + вода + рН 9. Пробирка 7. Пепсин + вода + рН 9.
Рис. 28. Оборудование для изучения субстратной специфичности пепсина
Алгоритм действий: 1. Перенести 1-ю пробирку из контейнера в штатив справа. 2. С помощью мышки поместить в пробирку белок (ВАРНА) и добавить пепсин. Добавить буферный раствор рН 2. 3. Перенести 2-ю пробирку из контейнера в штатив. Налить в нее белок и пепсин. Добавить буфер рН 7. 4. Повторяйте эти шаги, пока не заполните все пробирки согласно плану эксперимента. Примечание: вы можете работать и с меньшим числом пробирок! 5. Установите необходимое время и нажмите «Incubate». После окончания инкубации откроется окно спектрофотометра. 6. С помощью мышки переместите первую пробирку в держатель спектрофотометра слева и нажмите «Анализ». Показатель экстинции прибора прямо пропорционален концентрации аминокислот в растворе. 7. Повторите эту процедуру с другими пробирками. 8. Нажмите Record data для регистрации результатов эксперимента в таблице. 9. Уберите пробирки в контейнер. Запишите полученные результаты в тетрадь и сделайте выводы. Работа №3. ИЗУЧЕНИЕ СУБСТРАТНОЙ СПЕЦИФИЧНОСТИ ЛИПАЗЫ.
Липаза является липолитическим ферментом, который расщепляет липиды на глицерол и жирные кислоты. Оптимальная температура для действия липазы – 37-380С и слабощелочная среда. Активность липазы усиливается желчью, которая обладает способностью эмульгировать жиры, благодаря чему расширяется область действия этого фермента. Рис. 29. Оборудование для изучения субстратной специфичности липазы
Цель: продемонстрировать роль желчи в обеспечении оптимального режима активности липазы поджелудочной железы. Принцип действий: В пробирки вводят липазу и растительное масло и добавляют желчь. После инкубации исследуют рН. Снижение рН по сравнению с исходной доказывает появление жирных кислот в пробирке с желчью. Прежде, чем начинать эксперимент, составьте план опыта. Вы можете максимально использовать 7 пробирок, в которых должны быть смешаны 4 реактива. Вы можете также менять время инкубации (максимально до 90 мин) и температуру в термостате. Один из вариантов опыта: Пробирка 1. Масло + липаза + желчь + рН 9. Пробирка 2. Масло + липаза + вода + рН 9. Пробирка 3. Масло + липаза + желчь + рН 7. Пробирка 4. Масло + липаза + вода + рН 7. Пробирка 5. Масло + липаза + желчь + рН 2. Пробирка 6. Масло + липаза + вода + рН 2. Алгоритм действий: 1. Перенести 1-ю пробирку из контейнера в штатив справа. 2. С помощью мышки налить в пробирку растительного масла и добавить липазы и желчи. Добавить буферный раствор рН 9. 3. Перенести 2-ю пробирку из контейнера в штатив. Налить в нее растительное масло, липазу и воду. Добавить буфер рН 9. 4. Повторяйте эти шаги, пока не заполните все пробирки согласно плану эксперимента. Примечание: вы можете работать и с меньшим числом пробирок! 5. Установите необходимое время и нажмите «Incubate». После окончания инкубации откроется окно рН-метра. 6. С помощью мышки переместите первую пробирку в держатель рН-метра слева и нажмите «Измерить рН» (Measure pH). 7. Повторите эту процедуру с другими пробирками. 8. Нажмите Record data для регистрации результатов эксперимента в таблице. 9. Уберите пробирки в контейнер. Запишите полученные результаты в тетрадь и сделайте выводы. Попробуйте ответить на вопросы В Рабочей тетради.
|