Класифікація кристалів за типом зв’язку у кристалічній гратці
Розрізняють 4 типи хімічної взаємодії у кристалах: 1. Іонний, або гетерополярний, зв’язок. 2. Ковалентний, або гомеополярний, зв’язок. 3. Металічний зв’язок. 4. Молекулярний, або ван-дер-ваальсівський, зв’язок. Розглянемо детальніше ці типи зв’язку. Іонні кристали. У іонних кристалах електрони переходять від одного типу атомів до іншого, так що кристал складається з позитивних і негативних іонів. Іони розташовані таким чином, що кулонівське притягання між іонами різного знаку виявляється сильнішим за кулонівське ж відштовхування між іонами одного знаку. Отже, іонний зв’язок – це зв’язок, обумовлений електростатичною взаємодією протилежно заряджених іонів. Найбільш характерні іонні кристали – NaCl та CsCl. NaCl має гранецентровану кубічну гратку, причому атоми Na та Cl розташовані таким чином. У CsCl гратка об’ємноцентрована кубічна, у вузлах куба розміщені негативні іони Cl, а в центрі позитивний іон Cs. Енергію взаємодії двох довільних іонів, що знаходяться на відстані де Величину Перепишемо у вигляді
Якщо схематично зобразити внесок кожного із різновидів взаємодії у повну енергію, то пов’язана із відштовхуванням компонента буде швидко спадати при малих відстанях, а пов’язана із електростатичною взаємодією, зокрема із притяганням, буде поводити себе наступним чином. Суперпозиція цих двох залежностей дасть криву з мінімумом, тобто при деякому
Типовий представник ковалентного кристалу – вуглець. 4 зв’язки розташовані так, як наведено на рисунку. Направленість зв’язку – симетричні електронні хмари витягнуті від одного електрона до сусіднього. Насиченість – атоми розташовані так, що всі вони рівнозначні. Один з атомів розташований таким чином, що знаходиться у центрі тетраедру, який утворюють чотири оточуючі атоми. Елементарна гратка вуглецю є гранецентрованою кубічною, утвореною 8 такими тетраедрами. На цьому рисунку наведено 4 верхніх тетраедри із розташованими у протилежних кутках атомами, як показано. Додаткові атоми у центрах тетраедрів є у 1 і 3 верхнього шару, та 2 і 4 нижнього шару тетраедрів. Такі ж гратки із ковалентними зв’язками мають такі найпопулярніші напівпровідникові матеріали, як германій і кремній. Металічні кристали. Метали характеризуються високою електропровідністю, тому більша частина електронів у металі повинна бути вільною. Більшість металів мають відносно щільновпаковані структури: об’ємноцентровану кубічну, гранецентровану кубічну та гексагональну щільновпаковану гратку. Дві перші гратки нам знайомі з попередньої лекції. Гранецентровану гратку мають такі метали, як Cu, Ag, Au, Ga, Al. А що таке гексагональна щільновпакована гратка?
Молекулярні кристали. І, нарешті, молекулярні кристали. Вони складаються із молекул, з’єднаних силами Ван-дер-Ваальса. Ви ще не забули, що таке сили Ван-дер-Ваальса? Це сили міжмолекулярної взаємодії, тобто дещо спрощена модель, на основі якої отримано рівняння стану Ван-дер-Ваальса де І на цьому ми завершимо розгляд ідеальних кристалічних структур. І перейдемо до розгляду реальних кристалів. Отже,
|

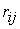 , у загальному випадку можна записати як
, у загальному випадку можна записати як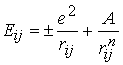 ,
,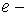 заряд електрону, + означає взаємодію іонів одного знаку,
заряд електрону, + означає взаємодію іонів одного знаку,  деякі величини. Перший доданок пов’язаний із електростатичною взаємодією. Він переважає на великих відстанях між атомами, коли їх взаємодію можна розглядати як взаємодію точкових зарядів. При малих відстанях проявляться сили відштовхування, пов’язані із взаємним проникненням електронних оболонок та відштовхуванням між однаково зарядженими атомними ядрами.
деякі величини. Перший доданок пов’язаний із електростатичною взаємодією. Він переважає на великих відстанях між атомами, коли їх взаємодію можна розглядати як взаємодію точкових зарядів. При малих відстанях проявляться сили відштовхування, пов’язані із взаємним проникненням електронних оболонок та відштовхуванням між однаково зарядженими атомними ядрами. , де
, де  відстань між сусідніми атомами. В свою чергу
відстань між сусідніми атомами. В свою чергу 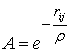 , де
, де 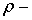 певна величина, що має розмірність відстані. Повну енергію гратки із
певна величина, що має розмірність відстані. Повну енергію гратки із 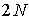 іонів можна записати як
іонів можна записати як  , де
, де  енергія, що припадає на один іон, а 2 відсутня, оскільки кожну пару атомів ми враховуємо лише один раз.
енергія, що припадає на один іон, а 2 відсутня, оскільки кожну пару атомів ми враховуємо лише один раз.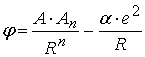 ,
, де
де  , а
, а  коефіцієнт, який має назву сталої Маделунга. Сталу Маделунга досить легко розрахувати, але за браком часу ми зупинятися на цьому не будемо, відсилаю вас до книжки Кіттеля, де це питання розглянуто докладно. Вкажу лише, що для NaCl
коефіцієнт, який має назву сталої Маделунга. Сталу Маделунга досить легко розрахувати, але за браком часу ми зупинятися на цьому не будемо, відсилаю вас до книжки Кіттеля, де це питання розглянуто докладно. Вкажу лише, що для NaCl  , для CsCl
, для CsCl 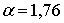 .
.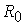 існує стан рівноваги сил притягання і відштовхування, де
існує стан рівноваги сил притягання і відштовхування, де ,
, 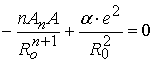 , звідки можна позбавитись
, звідки можна позбавитись 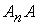 , і отримати
, і отримати ;
;  .
.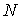 має величину ~10, тому легко переконатися, що повна енергія гратки при іонному зв’язку визначається кулонівською взаємодією.
має величину ~10, тому легко переконатися, що повна енергія гратки при іонному зв’язку визначається кулонівською взаємодією. Ковалентні кристали. Ковалентний зв’язок виникає через утворення класичної електронної пари. В хімії та особливо у неорганічній хімії цей зв’язок називають гомеополярним, щоб підкреслити однакову природу атомів, які взаємодіють, на відміну від гетерополярного іонного зв’язку. У чистому вигляді ковалентний зв’язок існує в кристалах хімічних елементів. Цей тип зв’язку характеризується великою густиною електронів між атомами і явно вираженою направленістю і насиченістю зв’язків.
Ковалентні кристали. Ковалентний зв’язок виникає через утворення класичної електронної пари. В хімії та особливо у неорганічній хімії цей зв’язок називають гомеополярним, щоб підкреслити однакову природу атомів, які взаємодіють, на відміну від гетерополярного іонного зв’язку. У чистому вигляді ковалентний зв’язок існує в кристалах хімічних елементів. Цей тип зв’язку характеризується великою густиною електронів між атомами і явно вираженою направленістю і насиченістю зв’язків.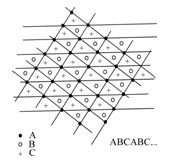 Як можна найщільніше розташувати атоми у гратці? Уявімо їх у вигляді кульок. Вони вкладуться гексагональним шаром А. Вони відмічені чорними кульками. Посунемо гратку так, щоб атоми зайняли місця кілець – шар В. Посунемо її ще раз, атоми змістяться у місця, позначені хрестиками – шар С. Шари АВСАВС… будуть повторюватися. Це і є гексагональна щільновпакована гратка.
Як можна найщільніше розташувати атоми у гратці? Уявімо їх у вигляді кульок. Вони вкладуться гексагональним шаром А. Вони відмічені чорними кульками. Посунемо гратку так, щоб атоми зайняли місця кілець – шар В. Посунемо її ще раз, атоми змістяться у місця, позначені хрестиками – шар С. Шари АВСАВС… будуть повторюватися. Це і є гексагональна щільновпакована гратка.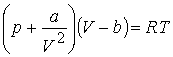 ,
, тиск газу,
тиск газу,  питомий об’єм,
питомий об’єм,  температура,
температура,  константи,
константи, 


