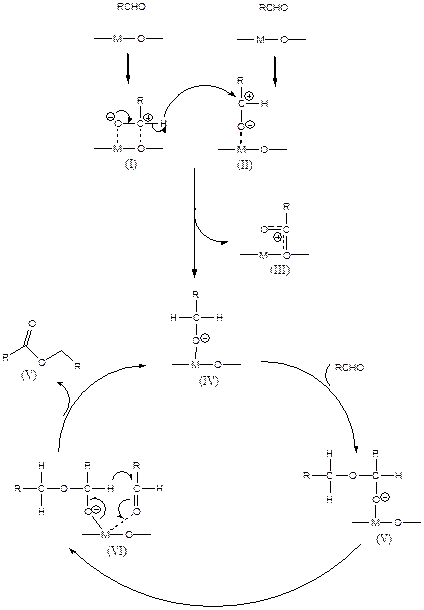Основные катализаторы
Твердые основные катализаторы, в отличии от кислотных, используются лишь в не большом количестве промышленных процессов. По химическому строению твердые основные катализаторы представляют собой, в основном, смесь оксидов щелочноземельных и щелочных металлов.
Оксиды щелочноземельных металлов. Наиболее изученным катализатором является MgO. На его поверхности протонодонорные вещества (НХ = вода, спирты, карбоновые кислоты, ацетиленовые углеводороды и т.д.) подвергаются диссоциативной гетеролитической хемосорбции:
В результате прокаливания при высокой температуре основность MgO сильно возрастает вследствии глубокого дегидроксилирования поверхности. В таком активированном состоянии оксид магния способен депротонировать даже такие слабые кислоты Бренстеда, как NН3 (рКа = 36) и пропилен (рКа = 35). Более того, была даже зафиксирована реакция гетеролитического распада Н2 на поверхности MgO.
Щелочные металлы. Еще один тип гетерогенных основных катализаторов - это щелочные металлы и их гидроокиси, нанесенные на пористый носитель (чаще всего Al2O3).
Гидротальцитоподобные материалы. Третий тип твердых основных катализаторов - гидротальцито-подобные материалы. Это твердые вещества, имеющие структуру, подобную гидротальцитам. Гидротальцит - это природная глина с химическим составом, описываемым формулой:
Mg6Al2(OH)16×4(H2O)
Структура гидротальцитоподобных материалов (Рис.5.51) сформирована из брусито-подобных слоев Mg(OH)2, в которых часть катионов Mg2+, замещена на Al3+. Избыточный положительный заряд алюминия компенсируется анионами СО32-, находящимися в межслойном пространстве. Там же находятся молекулы воды. Анионы СО32- можно обменивать на другие анионы, изменяя таким образом основные свойства гидротальцита. Кроме того гидротальциты можно синтезировать из катионов металлов (М2+/М3+), отличных от Mg2+ и Al3+, что также позволяет менять каталитические свойства этих материалов.
Рис. 5.51. Структура гидротальцита.
Изомеризация олефинов. Прокаленный при 700-900оС СаО является еще более сильным основанием, чем MgO. На обоих катализаторах активно протекает реакция изомеризации (миграции) двойной связи в олефинах. Например бутен-1 изомеризуется в бутен-2 благодаря образованию на поверхности катализатора промежуточного метилаллил-аниона в результате отрыва основными центрами катализатора протона в аллильном положении:
Наибольшей активностью в основно-каталитических реакциях обладают щелочные металлы нанесенные на Al2O3. Так 5%Na/Al2O3 приводит к полной конверсии 1-бутена в 2-бутен при 20оС. На таком катализаторе легко изомеризуются и высшие a-олефины.
Дегидрирование спиртов до карбонильных соединений. Благодаря легкости депротонирования спиртов (5.79) с образованием поверхностных алкоголятов (R-O-) оксид магния является хорошим катализатором дегидрирования спиртов до карбонильных соединений. Причем добавление к MgO небольших количеств ионов Со2+ (в качестве промотора) увеличивает селективность в этой реакции.
Дегидрогалогенирование. Оксиды щелочноземельных металлов хорошо катализируют реакцию дегидрогалогенирования галогеналкилов при температуре 100-200оС. Реакция протекает по механизму Е2:
В этой реакции обнаружен следующий ряд активности катализаторов: SrO >> CaO > MgO > Al2O3 - который точно отражает уменьшение основности оксидов.
Реакция Тищенко. Термически активированный ВаО катализирует реакцию Тищенко (которая в гомогенной среде катализируется алкоголятами алюминия):
Механизм катализа изображен на Схеме 5.83. Суть механизма заключается в образовании на поверхности катализатора комплекса (IV) из двух хемосорбированных молекул исходного альдегида (I) и (II). Комплекс обеспечивает каталитический цикл, приводящий к образованию продукта (V).
(5.83)
Применение основных гетерогенных катализаторов в промышленных процессах. Несмотря на многочисленные исследования гетерогенных основных катализаторов, в промышленности реализовано ограниченное количество процессов. Некоторые из них приведены в Таблице 5.25.
|

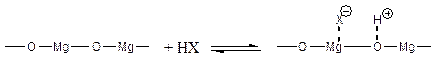 (5.79)
(5.79)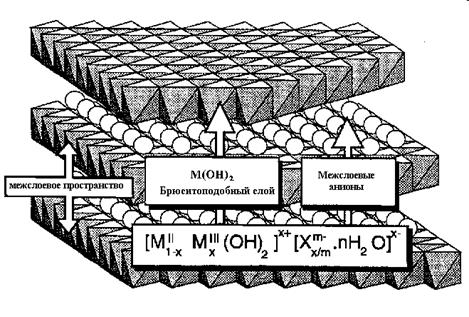
 (5.80)
(5.80) (5.81)
(5.81)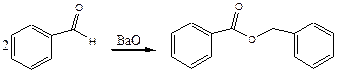 (5.82)
(5.82)