Кристаллическое строение и каталитическая активность металлов.
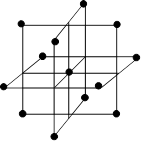
Уже из рассмотренных примеров становится очевидно, что геометрическое расположение активных центров на поверхности катализаторов значительно влияет на каталитическую эффективность. Наиболее ярко это влияние наблюдается у металлов, поэтому рассмотрим более подробно именно этот класс катализаторов. Расположение атомов металла на поверхности зависит от структуры кристаллической решетки. Для большинства металлов характерны три типа кристаллических решеток (Рис. 5.23): - гранецентрированная кубическая (гцк) - объемно-центрированная кубическая (оцк) - гексагональная плотноупакованная (гпу).
Рис. 5.23. Строение элементарных ячеек кристаллических решеток металлов.
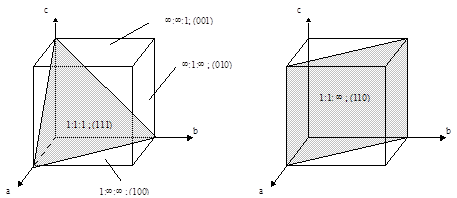
В гексагональной плотноупакованной (ГПУ) структуре каждый атом металла окружен 12-ю другими атомами, т.е. координационное число равно 12. В гранецентрированной кубической (ГЦК) координационное число также равно 12. В объемноцентрированной кубической (ОЦК) - 8. Строение поверхности катализаторов, естественно, отличается от строения в его объеме, поскольку на поверхности кристаллическая решетка обрывается, образуя кристаллографические плоскости. Для обозначения кристаллографических плоскостей используют индексы Миллера. Индексы Миллера для кристаллографической плоскости показывают, какие и сколько кристаллографических осей элементарной кристаллической решетки пересекает данная плоскость. Численно они равны обратным значениям длин отсекаемых отрезков, выраженных целыми относительными числами. На Рисунке 5.24 изображены кристаллографические плоскости для кубической кристаллической структуры.
1 2 3 Рис. 5.24. Примеры кристаллографических плоскостей в кубической структуре. Указаны соотношения длин отсекаемых отрезков и индексы Миллера.
Например, кристаллографическая плоскость, совпадающая с верхней гранью кубической элементарной ячейки пересекает только одну кристаллографическую ось "с". Обозначим длину отсекаемого отрезка - с. Оси "а" и "b" данная плоскость не пересекает, т.е. длины соответствующих отсекаемых отрезков (а и b) формально равны ¥. Тогда, длины отсекаемых отрезков соотносятся как:
¥:¥: с (5.28)
а обратные значения длин отрезков соотносятся как:
(1/¥):(1/¥):(1/ с) = 0:0:(1/ с) (5.29)
Чтобы выразить данное соотношение в целых числах, поделим все соотносящиеся величины на (1/ с) и получим:
0:0:1 (5.29)
Следовательно, рассмотренная кристаллографическая плоскость имеет обозначения в индексах Миллера (001). Они отражают тот факт, что плоскость пересекает только кристаллографическую ось "с" и параллельна осям "а" и "b". Соответственно, кристаллографическая плоскость пересекающая только ось "а" имеет индекс (100), а пересекающая только ось "b" имеет индекс (010) (Рис. 5.24 (1)). Рассмотрим кристаллографическую плоскость проходящую через противоположные ребра кубической ячейки и пересекающую только оси "а" и "b" на одинаковых расстояниях (Рис. 5.24 (2)). Поскольку отсекаемые отрезки имеют одинаковую длину, то индекс данной плоскости - (110). Плоскость, проходящая через вершины куба, лежащие на кристаллографических осях (Рис. 5.24 (1)), соответственно, имеет индекс (111). Плоскость, проходящая через две вершины куба, лежащие на кристаллографических осях "а" и "b" и через середину ребра, совпадающего с осью "с" (Рис. 5.24 (3)), отсекает отрезки, длины которых соотносятся как:
1:1:(1/2)
следовательно, обратные значения длин соотносятся как:
1:1:2
т.е. индекс данной кристаллографической плоскости - (112). Таким образом становится очевидным, что расположение атомов (а следовательно, активных центров) на поверхности катализатора зависит от структуры кристаллической решетки катализатора и индексов кристаллографических плоскостей, которыми решетка обрывается на поверхности катализатора. Во взаимодействии с субстратом участвуют не только атомы первого слоя поверхности, но и атомы второго слоя (правда, в меньшей степени), и, даже, атомы третьего слоя (в еще меньшей степени). Это определяется доступностью соответствующих слоев, которая зависит структуры решетки и индекса поверхности (Рис. 5.25). Как видно из рисунка для плоскостей (100) гцк легко доступными для хемосорбции являются только атомы первого слоя. Для остальных, представленных на рисунке плоскостей атомы второго слоя также доступны для взаимодействия с субстратом. А для плоскости (210) гцк потенциальной доступностью обладают и атомы третьего слоя. Поэтому, очевидно, что реакционная способность поверхностей, образованных плоскостями с различными индексами, будет различна.
Рис. 5.25. Примеры расположения атомов первых трех поверхностных слоев для различных кристаллографических плоскостей.
В объеме катализатора атомы кристаллической решетки координационно насыщены. Атомы на поверхности катализатора координационно не насыщенны и имеют свободные валентности. Этим и объясняется их каталитическая активность. В зависимости от индекса кристаллографической плоскости, которая образует поверхность катализатора, атомы имеют различное количество свободных валентностей и, следовательно, обладают различной каталитической активностью. На Рисунке 5.26 изображены три кристаллографические плоскости металлического Ni, расположение атомов в объеме и на поверхности, а также соответствующие координационные числа и свободные валентности. Видно, что наименее координационно насыщенными являются атомы на плоскости (110). Очевидно, что потенциально они обладают наибольшей активностью в хемосорбции. Но каталитическая активность будет определяться не только этим фактором, но и геометрией расположения поверхностных атомов и геометрией молекулы адсорбата.
Рис. 5.26. Количество окружающих атомов и свободных валентностей на различных кристаллографических плоскостях никеля в гкц кристаллической решетке.
Влияние типа упаковки и межатомного расстояния на каталитическую активность металлов иллюстрируется следующим примером. Было установлено, что только металлы имеющие плотнейшую упаковку (т.е. координационное число - 12, что достигается только у металлов с ГЦК и ГПУ решетками) и межатомные расстояния в диапазоне 0,248-0,277 нм катализируют реакцию дегидрирования циклогексана до бензола (Таблица 5,8). Это связано с тем, что при дегидрировании до бензола хемосорбированная промежуточная частица должна располагаться на поверхности катализатора строго определенным образом, кек изображено на Рисунке 5.27. Такое расположение возможно только для охарактеризованных выше металлов.
Таблица 5.8. Структура кристаллической решетки и межатомное расстояние (нм) для некоторых металлов.
* - Металлы, катализирующие дегидрирование циклогексана.
Рис. 5.27. Расположение хемосорбированной частицы на поверхности металлов с плотнейшей упаковкой при дегидрировании циклогексана до бензола.
Как было показано выше, в зависимости от кристаллографической плоскости, поверхностные атомы на ней располагаются определенным геометрическим образом (Рис. 5.25 и 5.26), поэтому различные кристаллографические поверхности даже одного и того же катализатора обладают различной каталитической активностью. Ярким примером служит активность металлического железа в реакции синтеза аммиака из азота и водорода. Установлено, что активность граней (110), (100) и (111) монокристалла металлического железа, имеющего ОЦК упаковку, в реакции гидрирования азота до аммиака соотносятся как 1:13:430. Наименьшую активность проявляет плоскость (110) на которой атомы железа наиболее удалены друг от друга, а наивысшую - плоскость (111) состоящая из наиболее близко расположенных атомов железа. Очевидно, что реальная поверхность промышленного катализатора состоит из множества малых кристаллитов, расположенных хаотически и имеющих набор различных кристаллографических плоскостей. Кроме этого, поверхность реального катализатора имеет целый ряд структурных дефектов (Рис. 5.28), таких как: терраса, излом, ступень (одно- и многоатомная), адсорбированный атом, вакансия.
Рис. 5.28. Структура поверхности в реальном катализаторе.
Террасы представляют собой протяженные участки, образованные одной кристаллографической плоскостью. Если терраса образована низкоиндексной плоскостью ((100), (110), (111)), то она проявляет все свойства этой плоскости. Но высокоиндексные плоскости могут образовывать более сложные многоступенчатые поверхности. Так, например, поверхность платины (557) представляет собой террасы (111), соединенные моноатомными ступенями (001). В ходе каталитической реакции структурные дефекты могут непрерывно исчезать и возникать. В результате этого наблюдается некоторая усредненная активность катализатора. Таким образом, в конечном итоге характер взаимодействия реагентов с поверхностными атомами катализатора определяется: - типом кристаллической решетки; - индексом кристаллографической плоскости, образующей поверхность, где расположен атом; - структурой поверхности (плоская терраса, излом, вакансия, ступень и пр.)
Рассмотрим влияние стерического фактора на примере реакции гидрирования этилена на Ni. Молекула этилена ассоциативно хемосорбируется на поверхности Ni, с разрывом p-связи и образованием двух s-связей с соседними атомами Ni (Рис. 5.29).
Рис. 5.29. Хемосорбция молекулы этилена на поверхности металлического никеля.
Оказалось, что поверхность (111) Ni намного менее активна в реакции гидрирования этилена, чем поверхности (100) и (110). Объяснение этому явлению можно дать с точки зрения влияния стерических факторов. Экспериментально установлено (методом ДМЭ (LEED)), что межатомные расстояния Ni-Ni на различных кристаллографических плоскостях составляют 0,25 и 0,35 нм, а длина связи С-С у хемосорбированного этилена 0,182 нм.
Таблица 5.9. Адсорбция и гидрирование этилена на разных кристаллографических плоскостях Ni.
По длинам межатомных расстояний в поверхностном комплексе можно вычислить угол связи Ni-С-С, который составляет 105о для плоскости (111) и 123о для плоскостей (100) и (110). Угол 105о по величине очень близок к тетраэдрическому (109о), поэтому связь в комплексе на плоскости (111) прочная и стабильная, и дальнейшая реакция протекает медленно. А на плоскостях (100) и (110) геометрическая ситуация менее выгодна. Хемосорбция менее прочная, молекула этилена более вытянута и более легко вступает в реакцию гидрирования. Суммарные данные приведены в Таблице 5.9. Аналогичный подход может быть распространен и на другие металлы. На Рисунке 5.30 приведена диаграмма влияния межатомного расстояния на поверхности (100) у металлов: Ta, Ni, Rh, Pd, Pt, Fe, W - на каталитическую активность в реакции гидрирования этилена.
Рис. 5.30. Относительная скорость гидрирования этилена, как функция межатомного расстояния на плоскости (100) переходных металлов.
Максимальную активность проявляет Rh у которого межатомное расстояние равно 0,375 нм (больше, чем у никеля, поэтому хемосорбированная молекула этилена более активирована и легче вступает в реакцию). При дальнейшем увеличении расстояния двухцентровая ассоциативная хемосорбция становится все слабее, что приводит к снижению концентрации активированных молекул на поверхности (а следовательно, и скорости реакции), вплоть до полной невозможности образовывать двухцентровой комплекс. При уменьшении расстояния металл-металл хемосорбция становится все более прочной, комплекс более стабильный и менее реакционно способный. Однако, ошибочным будет утверждение, что на каталитическую активность в рассмотренной модельной реакции влияет только геометрический фактор. Безусловно, необходимо учитывать и влияние энергетического фактора (теплота адсорбции). Но в данном, конкретном случае вклад геометрического фактора является определяющим.
|