Електричний струм в електролітах
Більшість чистих рідин погано проводить електричний струм. При розчиненні в рідині інших речовин її електропровідність значно збільшується. Наприклад, чиста вода дуже погано проводить електричний струм. При розчиненні у воді солей, кислот або лугів, вона стає добрим провідником електрики. Молекули води, як і інших полярних діелектриків, є електричними диполями, тобто являють собою системи двох однакових за величиною і протилежних за знаком зарядів. При розчиненні іонної сполуки у воді дипольні молекули води орієнтуються навколо молекули розчиненої речовини і послаблюють хімічний зв’язок в молекулі. Внаслідок теплового руху, зіткнень з іншими молекулами, така молекула розчиненої речовини розпадається на іони. Явище розпадання молекул на іони при розчиненні називається електролітичною дисоціацією, а самі розчини називаються електролітами. Крім дисоціації в розчині відбуваються і зворотні процеси рекомбінації або молізації, тобто утворення молекул при зіткненні двох протилежних за знаком іонів. Ступінь дисоціації розчиненої речовини характеризується коефіцієнтом дисоціації
Кількість молекул, які дисоціюють в одиниці об’єму за одиницю часу, пропорційна до кількості недисоційованих молекул, тому
де
При сталій температурі в електроліті існує динамічна рівновага між процесами дисоціації та рекомбінації, тому швидкості цих процесів рівні між собою
Підставимо (3.237) і (3.238) у вираз (3.239)
Звідси
де
Тобто, в сильно концентрованих розчинах коефіцієнт дисоціації обернено пропорційний квадратному кореню із концентрації розчиненої речовини. Зануримо в посудину з електролітом два електроди і приєднаємо їх до джерела електричного струму. Між електродами виникне електричне поле під дією якого іони разом з хаотичним тепловим рухом будуть здійснювати впорядковане переміщення. Позитивно заряджені іони (катіони) будуть рухатись до негативного електроду (катоду), негативно заряджені іони (аніони) будуть рухатись до позитивного електроду (аноду). На електродах іони нейтралізують свої заряди і перетворюються в нейтральні частинки. Таким чином, проходження електричного струму через електроліт супроводжується явищем електролізу – виділенням на електродах складових частин розчиненої речовини та інших речовин, які можуть виникати внаслідок вторинних хімічних реакцій. Провідники, в яких проходження струму супроводжується електролізом, називаються провідниками другого роду або електролітами. Англійський вчений М.Фарадей експериментально встановив два закони електролізу. Перший закон електролізу Фарадея: маса речовини, яка виділяється на кожному з електродів, прямо пропорційна величині заряду, який переноситься через електроліт
де
Підставимо вираз (3.243) у формулу (3.242) тоді перший закон електролізу набере вигляду
Другий закон електролізу Фарадея: електрохімічний еквівалент речовини прямо пропорційний хімічному еквіваленту
де Підставивши (3.245) у формулу (3.243) і (3.244) отримаємо об’єднаний закон електролізу Фарадея
Для електролітів справедливий закон Ома в диференціальній формі
де j – густина струму, q – заряд іона,
|

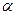 , який рівний відношенню кількості молекул дисоційованих на іони
, який рівний відношенню кількості молекул дисоційованих на іони  до загальної кількості молекул розчиненої речовини
до загальної кількості молекул розчиненої речовини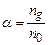 . (3.236)
. (3.236)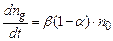 , (3.237)
, (3.237)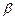 – коефіцієнт пропорційності. Кількість молекул рекомбінованих в одиниці об’єму за одиницю часу пропорційна як числу позитивних так і числу негативних іонів
– коефіцієнт пропорційності. Кількість молекул рекомбінованих в одиниці об’єму за одиницю часу пропорційна як числу позитивних так і числу негативних іонів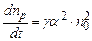 . (3.238)
. (3.238)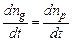 . (3.239)
. (3.239)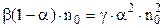 .
.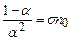 , (3.240)
, (3.240)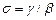 – постійна величина. Формула (3.240) пов’язує коефіцієнт дисоціації із концентрацією розчиненої речовини. В слабких розчинах з малою концентрацією розчиненої речовини
– постійна величина. Формула (3.240) пов’язує коефіцієнт дисоціації із концентрацією розчиненої речовини. В слабких розчинах з малою концентрацією розчиненої речовини  . Із формули (3.240) випливає, що при цьому коефіцієнт дисоціації
. Із формули (3.240) випливає, що при цьому коефіцієнт дисоціації 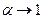 , тому в слабких розчинах майже всі молекули дисоційовані. Із збільшенням концентрації розчину коефіцієнт дисоціації зменшується. В сильно концентрованих розчинах
, тому в слабких розчинах майже всі молекули дисоційовані. Із збільшенням концентрації розчину коефіцієнт дисоціації зменшується. В сильно концентрованих розчинах 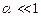 і, як випливає із формули (3.240)
і, як випливає із формули (3.240)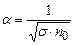 . (3.241)
. (3.241)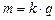 , (3.242)
, (3.242)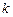 – електрохімічний еквівалент. Він чисельно рівний масі речовини, яка виділяється в результаті електролізу при проходженні електричного заряду в 1Кл. При проходженні постійного струму силою
– електрохімічний еквівалент. Він чисельно рівний масі речовини, яка виділяється в результаті електролізу при проходженні електричного заряду в 1Кл. При проходженні постійного струму силою  протягом часу
протягом часу 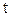 електричний заряд рівний
електричний заряд рівний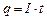 . (3.243)
. (3.243)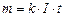 . (3.244)
. (3.244) , (3.245)
, (3.245)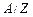 – хімічний еквівалент речовини, рівний відношенню атомної маси речовини
– хімічний еквівалент речовини, рівний відношенню атомної маси речовини 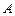 до її валентності
до її валентності 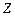 ,
, 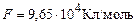 – постійна Фарадея.
– постійна Фарадея.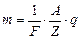 ;
; 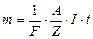 . (3.246)
. (3.246)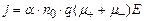 , (3.247)
, (3.247) та
та 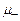 – рухливості катіонів та аніонів,
– рухливості катіонів та аніонів, 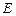 – напруженість електричного поля.
– напруженість електричного поля.


