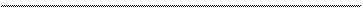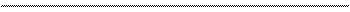Химические свойства диолов.
1. Взаимодействие со щелочными металлами: CH2 – OH CH2 – ONa 2 | + 2 Na → 2 | + H2↑ CH2 – OH CH2 – ONa неполный гликолят натрия CH2 – OH CH2 – ONa | + 2 Na → | + H2↑ CH2 – OH CH2 – ONa гликолят натрия 2. Взаимодействие с гидроксидом меди (II). Образуется ярко-синий гликолят меди (II) – это сложное, комплексное соединение (пунктиром указано связь образования по донорно-акцепторному механизму). H |
CH2 – OH CH – O O – CH | H гликолят меди (II) 3. Этиленгликоль реагирует со щелочами. CH2 – OH CH2 – ONa | + 2 NaОН → | + 2 H2О CH2 – OH CH2 – ONa гликолят натрия
4. Взаимодействие с азотной кислотой: CH2 – OH CH2 – ONO2 | + 2 HO – NO2 → | + 2 H2О CH2 – OH CH2 – ONO2 Динитрогликоль – сильно взрывчатое вещество, получают в промышленных масштабах и служит заместителем тринитроглицерина. С карбоновыми кислотами этиленгликоль образует сложные эфиры: CH2 – OH CH2 – O – CO – CH3 | + CH3 – COOH → | + H2O CH2 – OH CH2 – OH ацетат этиленгликоля
5. Дегидратация гликолей может быть внутримолекулярной и межмолекулярной: CH2 – OH | H2SO4 конц. CH2 → CH2 = CH – CH2 – OH + H2O | CH2 – OH
CH2 – CH2 CH2 – CH2 | | H2SO4 конц. | | CH2 CH2 → CH2 CH2 | | \ / OH OH O
При межмолекулярном отщеплении воды возможно образование циклического эфира. O / \ CH2 – OH H2SO4 конц. CH2 CH2 2 | → | | диоксан CH2 – OH CH2 CH2 \ / O
6. Окисление. Гликоли окисляются легче, чем одноатомные спирты. CH2 – OH | CH2 – OH
CHO | CH2 – OH
COOH CHO | | CH2 – OH CHO гликолиевая глиоксаль
COOH | COOH щавелевая кислота Этиленгликоль – незамерзающая жидкость – антифризы. Используются в автомашинах (радиаторах) при низких температурах, чтобы не замерзала жидкость. Этиленгликоль применяется для синтеза лавсана – ценного синтетического волокна.
|


 CH2 – OH CH2 – O O – CH2
CH2 – OH CH2 – O O – CH2
 2 | + Cu(OH)2 → | Cu | + 2H2O
2 | + Cu(OH)2 → | Cu | + 2H2O [O]
[O]