СЕЛЕКТИВНОСТЬ РЕАКЦИЙ АРОМАТИЧЕСКОГО БРОМИРОВАНИЯ АЛКИЛБЕНЗОЛОВ
Зубанова Е.А. Ивановский Государственный Университет, Иваново, Россия. Аспирант 2г. chip-master@live.ru Научный руководитель: Крылов Е.Н.
Реакции ароматического электрофильного замещения (в частности, реакция бромирования) используются для функционализации ароматических углеводородов, в том числе алкилбензолов, для их дальнейшего использования в органическом синтезе, например, при синтезе лекарственных препаратов. Ряд теоретических моментов требуют анализа на современном уровне. С синтетической точки зрения целесообразно применение «зеленых» реагентов, одновременно обеспечивающих нестандартную селективность указанных реакций, одним из которых является N-бромсукцинимид (NBS). Ряд теоретических моментов и сторон прикладного аспекта этих реакций требуют анализа на современном уровне. В частности, для анализа реакционной способности могут быть использованы индексы реакционной способности (ИРС), определяемые методами квантовой химии [1], причем этот вариант может оказаться предпочтительнее расчета поверхности потенциальной энергии [2]. При бромирования алкилбензолов с алкилами С1-С4 определены относительные скорости реакций (субстратная селективность) и изомерное распределение продуктов реакции (позиционная селективность). Обнаружено, что при использовании NBS в среде AcOH изомерное распределение отличается от обычного для бромировани Br2, поскольку наблюдается полное подавление мета-замещения. Побочный процесс замещения в боковой цепи подавлен малыми (~0.01 мольн%) добавками H2SO4. Для стерически затрудненных алкилбензолов (кумол, трет-бутилбензол) обнаружена аномально высокая (по сравнению со средой Ac2O) степень орто-замещения. Пара-/орто-позиционная селективность определяется стерическими эффектами заместителей с линейной корреляцией логарифма относительного количества изомеров на стерический параметр заместителя ES0. Сопоставление процессов в среде AcOH и CF3COOH показывает, что в более кислой CF3COOH замещение в боковых цепях не имеет места, а пара-/орто-селективность процесса подходит для синтеза прекурсоров витамина B2. Предполагается реализация согласованного механизма реакции бромирования с участием молекулы кислоты в качестве переносчика H+ от σ-комплекса на молекулу сукцинимида. Аналогичное исследование с определением селективностей проведено при бромировании алкилбензолов в среде ионной жидкости метилбутилимидазолий-трибромида, одновременно являющейся реагентом. Проведен корреляционный анализ соответствия между относительной реакционной способностью полиметилбензолов в реакции бромирования их Br2 в среде AcOH и динамическими квантовохимическими ИРС, основанными на теории DFT (функция Фукуи, глобальная и локальная жесткость и электрофильность). Заряды на атомах для расчета функции Фукуи определены в схемах NBO, GAPT и Хиршфельда (уровень теории B3LYP/6-311+G*, FireFly v. 7.1.G [1]). Зависимости соответствуют динамике переноса заряда от субстрата на электрофил и нуклеофильной поддержке реакции со стороны субстрата, что согласуется с обнаруженной корреляцией относительных констант скоростей бромирования полиметилбензолов на компонент тензора квадрупольной поляризуемости QZZ. Проведен расчет структур монозамещенных бензола XPh с заместителями X донорной и акцепторной природы в состоянии нейтральных молекул и катионов, моделирующих σ-комплексы реакции ароматического нитрования (уровень теории DFT/B3LYP/6-311G**. Определены величины функций Фукуи [2] для указанных субстратов (динамические квантовохимические дескрипторы реакционной способности), а также величины локальной мягкости и электрофильности. Относительные скорости, парциальные факторы скоростей изомерного замещения и относительное количество изомеров при нитровании алкилбензолов азотной кислотой в среде серной кислоты сопоставлены с квантовохимическими дескрипторами. Обнаружено корреляционное соответствие между указанными величинами, согласующееся с физическим смыслом функций Фукуи, локальной жесткости, локальной мягкости и электрофильности и предпочтительность использования динамических ИРС, описывающих процесс передачи электронной плотности от ароматического субстрата на электрофил в процессе образования интермедиата – σ-комплекса. Во всех случаях схемы NBO, GAPT и Хиршфельда предпочтительнее схемы Малликена. Проведено исследование реакции нитрования алкилбензолов с алкилами С1-С4 нормального и изостроения нитратом мочевины в различных средах. Определены относительные скорости реакций (субстратная селективность) и изомерное распределение продуктов реакции (позиционная селективность), коррелированная на стерические эффекты заместителей. Субстратная и позиционная селективности сходны с таковой, наблюдаемой при использовании азотной кислоты. Изомерный состав нитро-1,2-диметилбензолов подходит для одновременного синтеза прекурсоров витамина B2 и мефенаминовой кислоты.
Литература: [1]A.A.Granovsky,FireFly,ver.7.1.G. http://classic.chem.msu.su/gran/firefly/index.html [2] Chemical Reactivity Theory. A Density Functional View. / Chattaraj P.K., Ed. N.-Y.: CRC Press. 2009. Ch. 18. P. 255 – 267. [2] Xiao H., Chen L., Ju X., Ji G. Science in China. B. 2003. Vol. 46. No. 5. P. 453-464. ВЗАИМОДЕЙСТВИЕ ИМИДИНА С НИТРИЛАМИ, КООРДИНИРОВАННЫМИ К ПЛАТИНЕ(II)
Иванов Д.М. Санкт-Петербургский государственный университет, Санкт-Петербург, Россия. Студент III курса. dan1510@rambler.ru Научный руководитель: Гущин П. В.
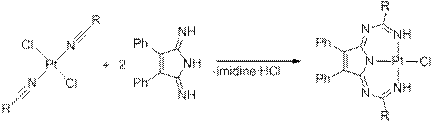
Взаимодействие транс -[PtCl2(RCN)2] (где R = Et, Ph, NMe2, NC5H10) с 2,5-диимино-3,4-дифенил-3-пирролином (имидином) в мольном соотношении 1:2 в СH2Cl2 при температуре 20−25°С приводит к образованию аддуктов необычной структуры (Схема 1).
Схема 1 Полученные соединения были охарактеризованы с помощью комплекса физико-химических методов анализа (элементный анализ, ESI масс-спектрометрия, ИК, ЯМР 1H, 13C{1H}), а строение двух из них в твёрдой фазе изучено с помощью метода РСтА. Работа выполнена при финансовой поддержке РФФИ (грант № 11-03-00483-a) и Президента РФ (грант для поддержки молодых российских учёных-кандидатов наук № MK-120.2011.3).
Литература: [1] Gushchin P. V., Tyan M. R., Bokach N. A., Revenco M. D., Haukka M., et al. Inorganic Chemistry 47, 11487-11500 (2008) [2] Kukushkin V. Yu., et al. Inorg. Synth. 31, 279 (1997) [3] Bokach N. A., Pakhomova T. B., Kukushkin V. Yu., Haukka M., Pombeiro A. J. L. Inorganic Chemistry 42, 7560-7568 (2003) [4] Vasil'ev S. I., Kulinich V. P., Shaposhnikov G. P., Smirnov R. P. Russian Journal of General Chemistry 68, 1264-1266 (1998)
|