ЦИКЛИЗАЦИЯ ОРТО-ВИНИЛ-N,N-ДИАЛКИЛАНИЛИНОВ
Зимовец О.А.,1 Платонова А.Ю.2 1 Уральский федеральный университет, Екатеринбург, Россия. Студент VI курса. o.zimovets@e1.ru 2 Уральский федеральный университет, Екатеринбург, Россия. Аспирант 2г. Научный руководитель: Глухарева Т.В.
Трет-амино эффект представляет особый интерес с точки зрения получения сложных конденсированных азотсодержащих гетероциклических систем [1-3]. Наши исследования в данной области направлены на изучение циклизации орто-винил-N,N-диалкиланилинов. На схеме 1 приведен пример подобной циклизации. Получаемые соединения интересны в плане поиска перспективных биологически активных соединений [4].
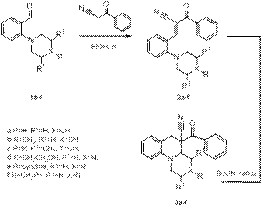
Схема 1. Пример циклизации по трет-амино эффекту (тип II) Для получения субстратов для циклизации были синтезированы орто-винил-N,N-диалкиланилины путем конденсации Кневенагеля орто-диалкиламинобензальдегидов с бензоилацетонитрилом. Для выявления факторов, влияющих на последующую циклизацию, для продуктов конденсации Кневенагеля нами было исследовано соотношение конфигурационных изомеров относительно двойной связи. Для этого реакционные массы были исследованы с помощью спектроскопии 1Н ЯМР. Было установлено, что в результате образуется только один изомер (в спектрах наблюдается один набор сигналов). Согласно квантово-химическим расчетам, подтвержденным результатами РСА, наиболее стабильным является транс-изомер. Для полученных соединений были проведены реакции циклизации по механизму трет-амино эффекта (схема 2).
Схема 2. Синтез конденсированных тетрагидрохинолинов Было показано, что в результате данной реакции образуется несколько диастереомеров, соотношение которых приведено в таблице 1. Таблица 1 Диастереомерный состав реакционных масс продуктов 3a-f
Таким образом, в ходе данного исследования было установлено, что в результате конденсации Кневенагеля образуется только один конфигурационный изомер, и эта стадия не является определяющей для формирования конфигурации продуктов 3a-f. Циклизация 2a-f по механизму трет-амино эффекта протекает диастереоселективно с образованием преимущественно одного изомера, доля которого составляет не менее 75%.
Литература: [1] Matyus P., Elias O., Tapolcsanyi P., Polonka-Balint A., Halasz-Dajka B. Synthesis 16, 2625 – 2639 (2006). [2] Verboom W., Reinhoudt D.N. Recl. Trav. Chim. Pays-Bas. 109, 311 – 324 (1990). [3] Tverdokhlebov A. V., Gorulya A. P., Tolmachev A. A., Kostyuk A. N., Chernega A. N., Rusanov E. B. Synthesis 13, 2161 – 2170 (2005). [4] Balasubramanian M., Keay J. G. in: Katritzky A. R., Rees C. W., Scriven E. F. V. Comprehensive Heterocyclic Chemistry II.– Oxford: Pergamon, 1996, 245 р.
|