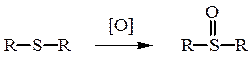СУЛЬФИДЫ
Простые тиоэфиры называют сульфидами. Их можно получить из галогеналканов и сульфидов щелочных металлов:
2 CH3CH2Br + K2S → СH3CH2 – S – CH2CH3 + 2 KBr
Сульфиды образуются также при перегонке меркаптидов свинца:
(CH3S) 2Pb → (CH3) 2S + PbS
Низшие тиоэфиры представляют собой жидкости, нерастворимые в воде и кипящие выше, чем меркаптаны. Запах чистых сульфидов не является неприятным, напоминает запах эфира. К тиоэфирам относится и известное отравляющее вещество «иприт» – β,β'-дихлордиэтилсульфид. Его получали из этилена и однохлористой серы:
2 CH2=CH2 + S2Cl2 → Cl – CH2CH2 – S – CH2CH2 – Cl + S
Химические свойства сульфидов обусловлены склонностью двухвалентной серы к переходу в высшие валентные состояния. 50%-ная азотная кислота окисляет тиоэфиры в сульфоксиды:
Диметилсульфоксид – один из наиболее применяемых высоко-полярных растворителей. Более сильные окислители (конц. HNO3, КMnO4) окисляют сульфиды и сульфоксиды до сульфонов.
диметилсульфон
Сульфоны – твердые кристаллические вещества. Некоторые сульфоксиды и сульфоны применяются в лекарственных средствах. Полисульфоны являются негорючими полимерами. Некоторые из них могут быть получены взаимодействием олефинов с оксидом серы (IV):
При алкилировании тиоэфиров галогеналканами или эфирами серной кислоты образуются сульфониевые соли:
Бромистый диметилэтилсульфоний и другие сульфониевые соли хорошо растворимы в воде. Их физические и химические свойства подобны свойствам четвертичных аммониевых соединений.
|