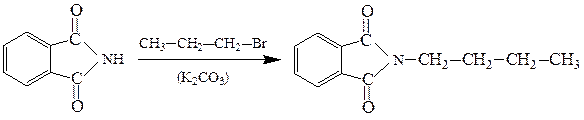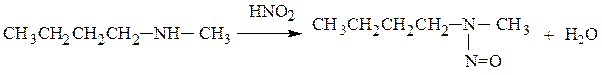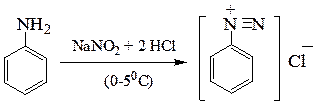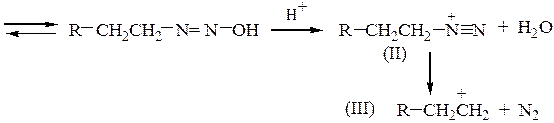Химические свойства
1. Основность аминов обусловлена способностью атомов азота присоединять протон к неподеленной паре электронов с образованием катионов аммонийного типа. Основность аминов измеряется константой равновесия реакции гидратации:
Основность амина тем выше, чем больше электронная плотность сосредоточена на атоме азота. Благодаря +I-эффекту алкильной группы алифатические амины (особенно третичные) имеют большую электрон- ную плотность на атоме N, чем аммиак, и следовательно, большую основность.
Ароматические амины вследствие сопряжения неподеленной пары электронов азота с p-электронным облаком бензольного ядра являются более слабыми основаниями, причем этот эффект усиливается при введении в ароматическое кольцо электроноакцепторных группировок.
С увеличением объемов заместителей, окружающих реакционный центр вещества, возрастают пространственные препятствия для его атаки молекулой реагента. Это также относится и к протонированию аминов. В связи с этим амины, содержащие большие радикалы, проявляют более слабые основные свойства по сравнению с ожидаемыми при рассмотрении только электронных эффектов радикалов, окружающих атом азота. 2. Алкилирование аминов. (C2H5)3N + C6H5CH2Cl ¾® [(C2H5)3NCH2C6H5]+ Cl―
Четвертичные алкильные соли при взаимодействии с водными растворами щелочей превращаются в гидрооксиды тетраалкиламмония, которые весьма устойчивы.
Расщепление четвертичных аммониевых оснований при нагревании по Гофману – пример схемы получения алкенов из галогеналканов против правила Зайцева:
3. Ацилирование аминов происходит при реакции с карбоновыми кислотами, их ангидридами или галогенангидридами и приводит к амидам кислот: С6Н5NH2 + (CH3CO)2O ¾® CH3CONHC6H5 + CH3COOH N-фениламид уксусной кислоты (ацетанилид)
Ангидриды двухосновных карбоновых кислот с первичными аминами образуют N-замещенные имиды:
N-бутилфталимид
4. Реакции аминов с азотистой кислотой. В зависимости от типа амина обработка азотистой кислотой приводит к различным продуктам реакции. Первичные алифатические амины при взаимодействии с азотистой кислотой выделяют азот с образованием спиртов или алкенов (с третич-ными углеводородными радикалами):
Вторичные амины образуют N-нитрозоамины:
N-нитрозометилбутиламин
Третичные амины алифатического ряда не взаимодействуют с НNO2, третичные жирно-ароматические амины (диалкилфениламины) нитрозируются в пара -положение бензольного кольца:
п- нитрозо-N,N-диметиламинобензол
Первичные ароматические амины образуют соли диазония (см. диазосоединения)
фенилдиазоний хлорид
Механизм реакций аминов с азотистой кислотой выглядит следующим образом:
В случае первичных аминов возникающий катион (I) теряет протон и превращается в диазогидрат, который в кислой среде переходит в соль диазония (II), разлагающуюся с образованием карбкатиона (III) и выделением азота:
Конечными продуктами являются спирты или алкены в зависимости от природы образующегося карбкатиона (III) (третичные карбкатионы легче образуют алкены). Соединения (II), у которых диазониевая группа находится при ароматическом кольце, устойчивы на холоду и могут быть получены взаимодействием первичных ариламинов со смесью нитрита натрия с минеральной кислотой при 0-10 0С. В случае вторичных аминов катион (I) отщепляет протон с образованием N-нитрозоамина:
В случае взаимодействия N,N-диметиламинобензола с азотистой кислотой механизм реакции выглядит следующим образом:
|

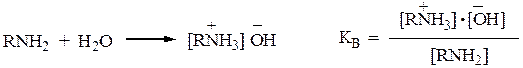




 N-пропиламид уксусной кислоты
N-пропиламид уксусной кислоты п -ацетотолуидин
п -ацетотолуидин